
| A. | 在放电条件下,N2和O2可直接化合生成NO | |
| B. | NO气体难溶于水 | |
| C. | 打开盛NO气体的瓶盖,立即看到瓶口有红棕色气体生成 | |
| D. | NO是红棕色气体 |
分析 A、氮气和氧气放电条件反应生成一氧化氮;
B、一氧化氮难溶于水;
C、一氧化氮遇到空气氧气会发生反应生成二氧化氮;
D、一氧化氮为无色气体.
解答 解:A、在放电条件下,N2和O2可直接化合生成NO,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,故A正确;
B、一氧化氮是难溶于水的气体,故B正确;
C、一氧化氮遇到空气氧气会发生反应生成二氧化氮,打开盛NO气体的瓶盖,立即看到瓶口有红棕色气体二氧化氮生成,故C正确;
D、一氧化氮为无色气体,二氧化氮为红棕色气体,故D错误;
故选D.
点评 本题考查了一氧化氮气体物理性质、化学性质的分析判断,掌握基础是关键,题目较简单.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物称为醇 | |
| B. | 能发生银镜反应的有机物都是醛 | |
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | |
| D. | 含较多饱和脂肪酸成分的甘油酯一般呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
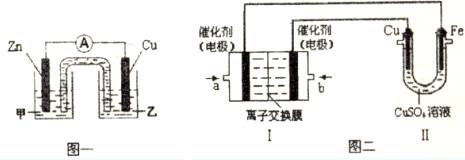
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子第五电子层只有2个电子,则该原子第四电子层的电子数肯定为8或18个 | |
| B. | 核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 | |
| C. | R为第二周期元素,其原子具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有 ①RO${\;}_{3}^{2-}$、②R2O${\;}_{4}^{2-}$、③RO${\;}_{4}^{2-}$ | |
| D. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

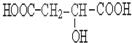 请回答:
请回答: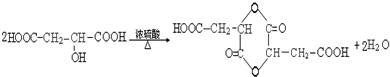 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
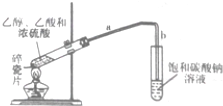 合成乙酸乙酯的路线如下:
合成乙酸乙酯的路线如下: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com