
工业上从海水制取溴时,是以氯气氧化海水中的Br-用空气将溴吹出,以氢氧化钠溶液吸收(Br2跟烧碱生成NaBr和NaBrO3),再用硫酸酸化得单质溴.
(1)写出前两步反应的化学方程式.
(2)如海水中溴的含量为0.027 %,计算多少吨海水可制得1.0 t溴.(假定溴无损失)
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)写出前两步反应的化学方程式.
(2)如海水中溴的含量为0.027 %,计算多少吨海水可制得1.0 t溴.(假定溴无损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从海水制取溴时,是以氯气氧化海水中的Br-,然后用空气将溴吹出,以氢氧化纳溶液吸收(Br2跟烧碱生成NaBr和NaBrO3)。再用硫酸酸化得单质溴。
(1)写出各步反应的化学方程式(写出其中任意两个)。
(2)如海水中溴的含量为0.027%.计算多少吨海水可制得1.0t溴 (假定溴无损失)。
查看答案和解析>>
科目:高中化学 来源:2009年安徽省合肥一中高考化学冲刺最后一卷(解析版) 题型:填空题
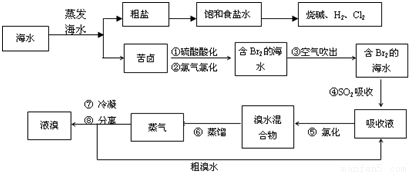
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com