
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
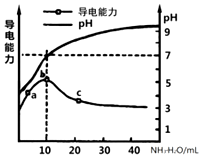 常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | a、b点所示溶液中水的电离程度不相同 | |
| C. | b恰好完全中和,pH=7说明NH4R没有水解 | |
| D. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用 0.1mol/L 的 NaOH 溶液滴定 pH 值相等的CH3COOH和 HCN 溶液,CH3COOH消耗的NaOH溶液体积 更大 | |
| C. | NaHS 和Na2S 的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的 pH=d,则其中由水电离出的c(OH-)=10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 | |
| B. | 若平衡时,甲、乙两容器中A的物质的量相等,则x=2 | |
| C. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=3 | |
| D. | 若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2.反应从逆反应方向开始,则D的起始物质的量应满足的条件是n(D)>$\frac{4}{3}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
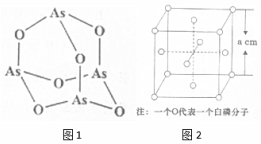 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: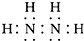 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6O2属于酯时有三种同分异构体 | |
| B. | 乙醇、乙酸均能与钠反应放出H2,二者分子中官能团相同 | |
| C. | 向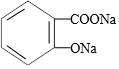 溶液中通入CO2可得到 溶液中通入CO2可得到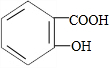 | |
| D. | CH3COOH与CH3CH218OH发生酯化反应可生成CH3CO18OCH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com