
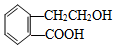 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.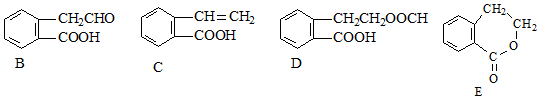
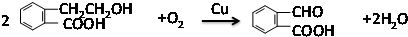 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
. 分析 (1)分子式相同、结构不同的有机物互称同分异构体;
(2)A含有羟基、羧基,发生催化氧化生成醛,发生酯化反应生成酯;
(3)根据苯环、乙烯、甲醛、甲酸为平面型结构判断;
(4)C含有碳碳双键,可发生加聚反应.
解答 解:(1)分子式相同、结构不同的有机物互称同分异构体,A-E分子结构分析可知,C和E分子式相同,但结构不同,为同分异构体关系,故答案为:C和E;
(2)A含有羟基,可发生催化氧化生成醛,方程式为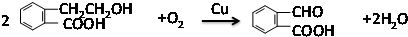 ,
,
A含有羟基、羧基,可发生酯化反应,方程式为 ,
,
故答案为: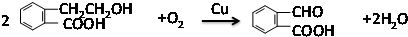 ;氧化反应;
;氧化反应; ;酯化反应;
;酯化反应;
(3)A、B、D、E中都含有CH2原子团,具有甲烷的结构特征,所有的原子不可能在同一个平面上,而C具有苯、乙烯以及HCOOH的结构特点,为平面型结构,
故答案为:C;
(4)C中含有C=C官能团,可发生加聚反应,该高聚物的结构简式为 ,反应的方程式为n
,反应的方程式为n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,知道物质发生反应的条件,侧重考查学生知识运用能力,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
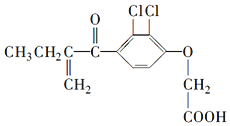
| A. | 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| B. | 利尿酸分子内处于同一平面的原子不超过10个 | |
| C. | 1mol利尿酸能与7mol H2发生加成反应 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
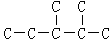 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com