
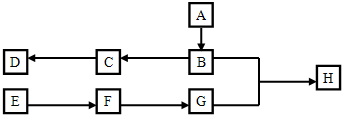
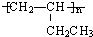 ;
;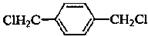 ,F为
,F为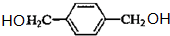 ,G为
,G为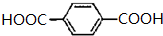 ;
; .
.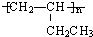 ,则由C生成D的化学方程式是:
,则由C生成D的化学方程式是: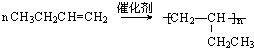 ,
,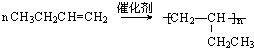 ;
;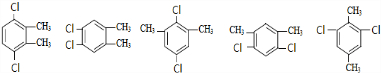 ,故符合条件的同分异构体共有6种,故答案为:6;
,故符合条件的同分异构体共有6种,故答案为:6; ,F为
,F为 ,G为
,G为 ,G的名称为对苯二甲酸,故答案为:
,G的名称为对苯二甲酸,故答案为: ;对苯二甲酸;
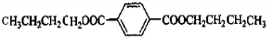
;对苯二甲酸; ,则由G和B生成H的化学方程式是:
,则由G和B生成H的化学方程式是: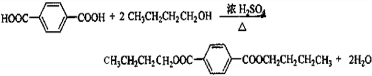 ,
, ,酯化反应.
,酯化反应.


科目:高中化学 来源: 题型:
A、20℃时,KNO3的溶解度S=
| ||
B、该溶液的质量分数W (KNO3)=
| ||
C、该溶液的物质的量浓度C (KNO3)=
| ||
D、该溶液的密度ρ=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
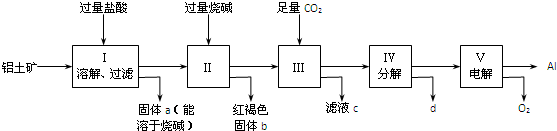
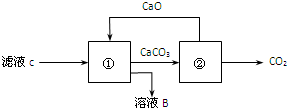
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
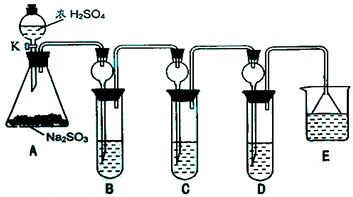 某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.
某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤、洗涤干净备用. | / |
| 用另一干净试管取少量沉淀样品,加入 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com