
| A. | 将△H<0的氧化还原反应设计成原电池,将化学能转变为电能 | |
| B. | 轮船水线以下的船壳上,嵌一定数量的锌块,保护船体不被腐蚀 | |
| C. | 在锌与稀硫酸反应的溶液中加入少量CuSO4,能加快生成H2的速率 | |
| D. | 为了保护地下钢管不受腐蚀,将它与一定电压的直流电源的负极相连 |
分析 A、自发的放热的氧化反应反应能设计成原电池;
B、活泼性不同的两种金属遇到合适的电解质溶液能构成原电池,较活泼的金属作负极,负极易失电子被腐蚀;
C、原电池原理可使反应速率加快;
D、作电解池阳极的金属加速被腐蚀,作阴极的金属被保护;
解答 解:A、自发的放热的氧化反应反应能设计成原电池,将化学能转变为电能,与原电池原理的应用有关,故A不选;
B、轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应,与原电池原理的应用有关,故B不选;
C、滴入少量硫酸铜溶液后,锌把铜置换出来形成原电池反应,故加快反应速率,可用原电池原理解释,与原电池原理的应用有关,故C不选;
D、作电解池阳极的金属加速被腐蚀,作阴极的金属被保护,为保护地下钢管不受腐蚀,可使其与直流电源负极相连,与电解池原理应用有关,故D选.
故选D.
点评 本题是对电化学知识的考查题,解题的关键是对相关的事实进行分析,只要是存在原电池的反应,则与原电池原理的应用有关.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | |
| B. | 用漂白液杀菌、消毒 | |
| C. | 用Na2SiO3溶液制备木材防火剂 | |
| D. | 用浸泡过高锰酸钾的硅藻土保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都不能用铝制容器贮存 | |
| B. | 滴在紫色石蕊试纸上,试纸都变黑 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、2H、3H互为同素异形体 | |
| B. | H2S分子中的化学键为非极性共价键 | |
| C. | S2-的结构示意图: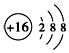 | |
| D. | NH4Cl的电子式: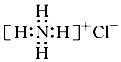 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+═CaCO3↓ | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:H2O2═H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com