
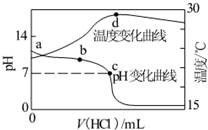
 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | 氨水的电离程度a>b>c | |
| B. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | d点时溶液温度达到最高,之后温度略有下降,原因是NH3•H2O电离吸热 |
分析 A、氨水中加入盐酸中和氢氧根离子,氨水的电离程度增大;
B、温度越高水的离子积越大;
C、盐酸与一水合氨恰好中和时溶液显酸性;
D、根据d点盐酸和氨水恰好完全反应,放热最多分析.
解答 解:A、加入盐酸过程中,一水合氨的电离程度a<b<c,故A错误;
B、d点温度高于a点,水的离子积Kw(a)<Kw(d),故B错误;
C、溶液显中性时,盐酸物质的量小于一水合氨,所以c点消耗盐酸体积V(HCl)<20.00mL,故C正确;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选C.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用弱电解质的电离、盐类水解来解答此类习题.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH | |
| B. | 实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 | |
| C. | 可用重结晶法提纯含少量NaCl的KNO3晶体 | |
| D. | 容量瓶、滴定管上都标有使用温度,容量瓶无“O”刻度,滴定管有“O”刻度,使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
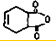 一种生产除虫剂胺菊酯的重要原料,其合成路线如下:
一种生产除虫剂胺菊酯的重要原料,其合成路线如下: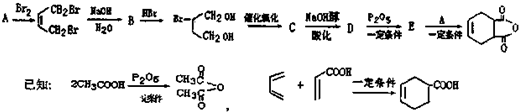
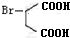 ,A的系统命名为1,3-丁二烯;
,A的系统命名为1,3-丁二烯; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-=3I2+2H2O | |
| B. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| C. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2=2I2+2Fe3++6C1- | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用废油脂制肥皂 | |
| B. | 袋装食品常用生石灰包作为食品的抗氧化剂 | |
| C. | 配制CuSO4溶液时加入少量的稀硫酸 | |
| D. | 用钠和钠的化合物做焰色反应实验,焰色均为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃着的酒精灯不慎碰到失火,应立即用湿布盖灭 | |
| B. | 酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗 | |
| C. | 用浓氨水洗涤做过银镜反应的试管 | |
| D. | 测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
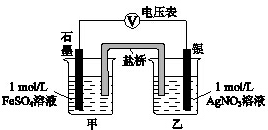 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
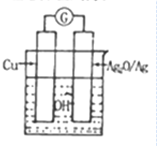 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.| A. | 工业上制备水泥的原料有黏土、石灰石、石膏 | |
| B. | 测量原理装置图中Ag2O/Ag极发生还原反应 | |
| C. | 负极的电极反应式为2Cu+H2O-2e-=Cu2O+2H+ | |
| D. | 在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com