
【题目】目前海水提溴的最主要方法之一是空气吹出法,工艺流程如下:

以下推断不合理的是
A.流程中循环利用的物质有SO2、Br2、Cl2,等多种
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C.空气能吹出溴是利用溴易挥发的性质
D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
科目:高中化学 来源: 题型:
【题目】实验室可以用乙醇和浓硫酸在170℃时制乙烯,化学反应原理为CH3CH2OH![]() CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):
CH2=CH2↑+H2O。由于浓硫酸具有强氧化性,故该反应的副产物有二氧化硫和二氧化碳等。某同学根据上述信息和相应的实验目的选择下列实验装置设计。实验(每种装置都有若干个):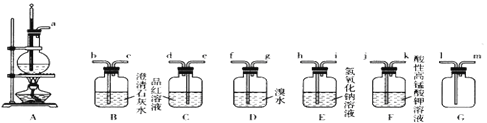
请回答下列问题:
(1)验证乙醇与浓硫酸混合反应产生了二氧化硫和二氧化碳。
①选择必要装置并进行连接:a→__________________(填接口序号)。
②确定混合气体中有二氧化碳存在的实验依据_________________________________。
(2)选择装置制备1,2—二溴乙烷。
①该同学设计的方案中装置连接顺序为A→E→D。此方案是否合理?_________(填“合理”或“不合理”);若不合理,请提出改进方案或方法____________________。
②分离出1,2—二溴乙烷的操作中使用的玻璃仪器为________________________。
③有同学建议在A、E之间增加G装置,其作用是_______,a与G装置接口_______(填“1”或“m”)连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
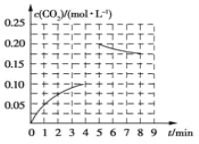
A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4溶于水并和水反应:NaBH4+2H2O![]() NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
A. NaBH4中的H得到电子,转化为H2
B. NaBH4中的Na失去1个电子
C. 硼元素被氧化,氢元素被还原
D. 被氧化与被还原的元素质量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.强酸性环境中K+、Na+、 Cl- 、HCO3- 不能大量共存:HCO3-+H+=CO2 +H2O
B.碳酸钠溶液显碱性:CO32-+2H2O ![]() H2CO3 +2OH-
H2CO3 +2OH-
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
D.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态铜原子的电子排布式为_____;价电子中成对电子数有_____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3 分子中的中心原子的杂化方式是_____。
②P 与 N 同主族,其最高价氧化物对应水化物的酸性:HNO3_____H3PO4(填“>”或“<”),
(3)某磷青铜晶胞结构如下图所示。
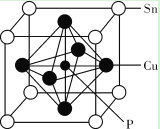
①则其化学式为_____。
②该晶体中距离 Cu 原子最近的 Sn 原子有_____个,这些 Sn 原子所呈现的构型为_____。
③若晶体密度为 8.82 g/cm3,最近的 Cu 原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。请回答:
(1)若常温下Y的单质能与水发生反应,X原子序数大于Y,则X位于周期表的_____,X、Y形成简单离子半径大小关系为X______(填“大于”“小于”或“等于”)Y。395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是_____________。
(2)若甲灼烧时,火焰呈现砖红色,且与盐酸反应时产生有刺激性气味气体。则甲为__(填化学式)。该气体能使高锰酸钾溶液褪色,反应的离子方程式为_____。
(3)若X、Y是不同周期的短周期元素,甲与盐酸反应逸出无色无味气体乙。
则:①乙中所含化学键类型为_______。
②该反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com