
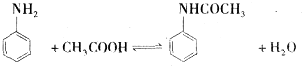

| 试剂名称 | 相对分子质量 | 密度g/mL | 熔点℃ | 沸点℃ | 溶解度 |
| 苯胺 | 93 | 1.02 | -6.2 | 184.4 | 稍溶于水,与乙醇、乙醚、苯混溶 |
| 乙酸 | 60 | 1.05 | 16.7 | 118 | 溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 1.21 | 114~116 | 280~290 |
| 2 |
| 3 |
| 1 |
| 3 |
| 5.1g |
| 93g/mol |
| 7.77g |
| 60g/mol |
| 2 |
| 3 |
| 1 |
| 3 |
| 5.1g |
| 93g/mol |
| 7.77g |
| 60g/mol |
| 4.0g |
| 7.425g |


科目:高中化学 来源: 题型:
| A、大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O |
| C、向澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、氨水中通入过量二氧化硫:2NH3?H2O+SO2=2NH4++SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCI | NH4HCO3 | NaHCO3 | NH4CI | Na2SO4 | (NH4)SO4 | CaCI2 | MgCI2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| M(混合物) | 9.2g | 15.7g | 27.6g |
| V(标准状况) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙为初中化学常见物质,其中乙为胃液中的一种酸.他们相互转化关系如图所示(“→”表示物质变化,部分反应条件和部分生成物已省略).
甲、乙、丙为初中化学常见物质,其中乙为胃液中的一种酸.他们相互转化关系如图所示(“→”表示物质变化,部分反应条件和部分生成物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②⑤ |
| C、①④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3?H2O?NH4++OH- | K=1.8×10-5 |
| Na2CO3 |
| 加热 |
| 75%酒精 |
| 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、土壤中含有铁粉、二氧化锰等 |
| B、黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料 |
| C、土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu或Cu2O |
| D、土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe304或FeO和红色Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com