
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,其氧化物是形成酸雨的重要原因 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
(1)X能形成多种常见单质,在硬度最大的单质中,原子的杂化方式为_______。
(2)Z位于元素周期表的位置是___,Y的氢化物空间构型是_____。
(3)在H-Y、H-Z两种共价键中,键的极性较强的是______,X所在周期元素中氢化物最稳定的是______(用具体元素符号表示)。
(4)下列有关X2H4的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为4:1
C.它是由极性键和非极性键构成的非极性分子
D.分子的空间构型为直线形
(5)向含有W2+的溶液中逐滴加入氨水至过量,期间出现的现象是________,写出最后所得配离子的结构式,要求标出配位键____。
【答案】 sp3 第三周期VIIA族 V形 H-Cl HF C 生成蓝色沉淀,然后逐渐溶解,最后得到深蓝色溶液 
【解析】X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,根据构造原理,X的核外电子排布式为1s22s22p2,X为C元素;Y单质是淡黄色固体,常在火山口附近沉积,其氧化物是形成酸雨的重要原因,Y为S元素;Y位于第三周期,Z和Y同周期,Z的电负性大于Y,Z为Cl元素;W的一种核素的质量数为63,中子数为34,质子数为63-34=29,W为Cu元素。
(1)碳元素形成的硬度最大的单质为金刚石,金刚石中C为sp3杂化。
(2)Cl位于第三周期第VIIA族。Y的氢化物为H2S,H2S的空间构型为V形。
(3)非金属性Cl![]() S,键的极性较强的是H-Cl。X处于第二周期,第二周期元素的氢化物中最稳定的是HF。
S,键的极性较强的是H-Cl。X处于第二周期,第二周期元素的氢化物中最稳定的是HF。
(4)X2H4为C2H4。A项,H原子不满足8电子稳定结构;B项,C2H4的结构式为![]() ,其中σ键和π键数目之比为5:1;C项,C-H键为极性键,碳碳双键为非极性键,分子的空间构型为平面形,为非极性分子;D项,分子的空间构型为平面形。
,其中σ键和π键数目之比为5:1;C项,C-H键为极性键,碳碳双键为非极性键,分子的空间构型为平面形,为非极性分子;D项,分子的空间构型为平面形。
(5)向含Cu2+的溶液中逐滴加入氨水至过量,实验现象是:生成蓝色沉淀,然后逐渐溶解,最后得到深蓝色溶液。形成的配离子为[Cu(NH3)4]2+,该配离子中由NH3分子中N原子提供孤电子对与Cu2+的空轨道共用。
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,根据构造原理,X的核外电子排布式为1s22s22p2,X为C元素;Y单质是淡黄色固体,常在火山口附近沉积,其氧化物是形成酸雨的重要原因,Y为S元素;Y位于第三周期,Z和Y同周期,Z的电负性大于Y,Z为Cl元素;W的一种核素的质量数为63,中子数为34,质子数为63-34=29,W为Cu元素。
(1)碳元素形成的硬度最大的单质为金刚石,金刚石中C为sp3杂化。
(2)Z为Cl元素,Cl原子核外有3个电子层,最外层有7个电子,Cl位于第三周期第VIIA族。Y的氢化物为H2S,H2S中中心原子S上的孤电子对数为![]() (6-2
(6-2![]() 1)=2,成键电子对数为2,价层电子对数为4,VSEPR模型为四面体型,由于S上有两对孤电子对,H2S的空间构型为V形。
1)=2,成键电子对数为2,价层电子对数为4,VSEPR模型为四面体型,由于S上有两对孤电子对,H2S的空间构型为V形。
(3)非金属性Cl![]() S,Cl原子吸引共用电子对的能力强于S,键的极性较强的是H-Cl。X处于第二周期,同周期从左到右气态氢化物稳定性逐渐增强,第二周期元素的氢化物中最稳定的是HF。
S,Cl原子吸引共用电子对的能力强于S,键的极性较强的是H-Cl。X处于第二周期,同周期从左到右气态氢化物稳定性逐渐增强,第二周期元素的氢化物中最稳定的是HF。
(4)X2H4为C2H4。A项,H原子不满足8电子稳定结构,A项错误;B项,C2H4的结构式为![]() ,单键全为σ键,双键中含1个σ键和1个π键,每个C2H4分子中σ键和π键数目之比为5:1,B项错误;C项,C-H键为极性键,碳碳双键为非极性键,分子的空间构型为平面形,正负电中心重合,为非极性分子,C项正确;D项,C2H4中C原子采取sp2杂化,分子的空间构型为平面形,D项错误;答案选C。
,单键全为σ键,双键中含1个σ键和1个π键,每个C2H4分子中σ键和π键数目之比为5:1,B项错误;C项,C-H键为极性键,碳碳双键为非极性键,分子的空间构型为平面形,正负电中心重合,为非极性分子,C项正确;D项,C2H4中C原子采取sp2杂化,分子的空间构型为平面形,D项错误;答案选C。
(5)向含Cu2+的溶液中逐滴加入氨水至过量,随着氨水的滴入,依次发生的反应为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++4H2O +2OH-,实验现象是:生成蓝色沉淀,然后逐渐溶解,最后得到深蓝色溶液。形成的配离子为[Cu(NH3)4]2+,该配离子中由NH3分子中N原子提供孤电子对与 。
。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】己知1mol 链烃CxHy可以发生如下系列转化:CxHy![]() Q
Q![]() CxCl12(无机试剂是足量的)下列说法错误的是
CxCl12(无机试剂是足量的)下列说法错误的是
A. x=5、n=11
B. 用酸性高锰酸钾溶液可以区分CxHy和Q
C. 上述转化过程中依次发生了加成反应和取代反应
D. CxCl12可能的结构有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
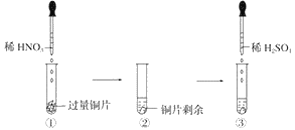
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明
显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
![]()
![]()
![]()
![]()
![]()
则操作①的名称为________,试剂A的化学式为________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________(填化学式),产生该白色沉淀的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过查阅资料得知,CO2与Na2O2的反应需要在一定量水蒸气存在的条件下才能进行,于是他们设计了如图所示的装置对此问题进行探究,同时验证Na2O2与CO2反应的气体产物。

(1)写出装置A中有关反应的离子方程式:_________________,装置B中的试剂是____,装置E的作用是_____________。
(2)U形管C中的试剂是____。若要求根据装置D中的现象来确定CO2与Na2O2之间的反应是否需要在潮湿的条件下才能进行,对两个止水夹的操作方式为先打开K1,关闭K2,D中无明显现象;当打开K2,关闭K1,D中的现象为 ______________,则说明反应需要在潮湿条件下进行。
(3)检验气体产物的方法:用玻璃片在水里盖住集气瓶口,将集气瓶从水中取出,正放在实验台上,_______________。
(4)有人认为,经过较长时间反应后,装置D中生成的物质只有Na2CO3而没有NaOH。请设计一个方案证明此结论是正确的:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g)CO(g)+H2(g) 。下列条件的改变对反应速率几乎没有影响的是( )
A. 增加C的量;
B. 减少CO的量;
C. 升高反应体系的温度;
D. 保持压强不变,充入He以增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y的核电荷数分别是a和b,它们的离子Xn+和Ym-的核外电子排布相同,则下列关系式中正确的是( )
A. a=b+m+n B. a=b-m+n
C. a=b+m-n D. a=b-m-n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)B为__________(填写元素符号),D的最高价氧化物对应的水化物是_________(填写化学式),离子半径大小B_________C(填“>”“<”或“=”);
(2)写出A、B的化合物与E反应的化学方程式:______________________;A、B两元素形成的化合物属于_________(填“离子”或“共价”)化合物。
(3)A的单质与D的最高价氧化物对应的水化物反应的化学方程式为_______________。
Ⅱ.常温下由三种短周期元素形成的气体单质X、Y、Z,有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(4)化合物甲的电子式是_____________;化合物丙中存在的化学键为___________、_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。下列有关说法正确的是
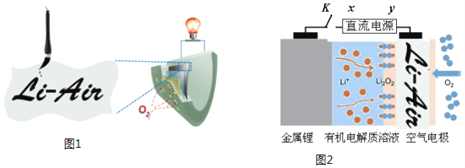
A. 放电时,纸张中的纤维素作锂电池的正极
B. 开关K闭合给锂电池充电,X为直流电源负极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为:Li2O2+2e-=O2↑+2Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com