
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。
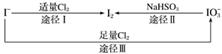
下列说法中不正确的是( )
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸不会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO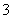
D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
| Na | Cu | Al | Fe | |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
根据以上数据判断其中不能形成合金的是( )
A.Cu和Al B.Fe和Cu
C.Fe和Na D.Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3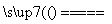 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 ΔH<0
4NH3↑+SiH4↑+2MgCl2 ΔH<0

①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是_______________________________________
________________________________________________________________________。
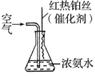
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________________。将0.184 g三硅酸镁加入
到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中n的值为__________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:

回答下列问题:
(1)混合①中发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,在A处通入氯气,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处干燥的红布条逐渐褪色。则D瓶中盛放的溶液不可能是( )
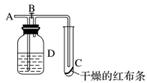
A.浓硫酸
B.NaOH溶液
C.饱和Na2SO3溶液
D.饱和氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填序号)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量NaOH固体,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途。工业上通过氯碱工业生产氯气,其反应的离子方程式为________________________________。室温下,用惰性电极电解100 mL饱和食盐水,当阴极产生标准状况下11.2 mL气体,忽略溶液体积的变化时,所得溶液的pH=______。
(3)常温下,已知25 ℃时有关弱酸的电离常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, K2=5.6×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________________________________________________________。
若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因________________________________________________________________________
________________________________________________________________________。
(4)服用含碘化钾的碘药片可抗核辐射。将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色。完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):______+______+______—→______HIO3+______。
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿,现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用?
已知:在0 ℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.61 J·mol-1·K-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1。
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O∶nC2H4=1∶1)。
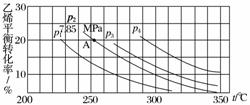
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________________________________________________________________________
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p1、p2、p3、p4)的大小顺序为__________,理由是________________________________________________________________________
________________________________________________________________________。
③气相直接水合法常用的工艺条件为磷酸/硅藻土为催化剂,反应温度290 ℃、压强6.9 MPa,nH2O∶nC2H4=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有________________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( )
A.直线形 B.平面正方形
C.正四面体形 D.正八面体形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com