


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
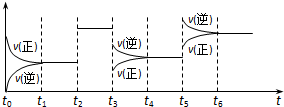
| A、t5时增大了压强 |
| B、t3时降低了温度 |
| C、t2时加入了催化剂 |
| D、t4~t5时间内转化率一定最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ |
| C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(X)=0.03mol/(L?min) |
| B、V(Y)=0.02mol/(L?min) |
| C、V(Z)=0.10mol/(L?min) |
| D、V(W)=0.02mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890kJ/mol |
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+890kJ/mol |
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol |
| D、0.5CH4(g)+O2(g)=0.5CO2(g)+H2O(l);△H=-890kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝的表面容易形成致密的氧化膜,抗腐蚀性能好 |
| B、常温下不与任何酸、碱反应 |
| C、铝元素在地壳中的含量高,储量丰富 |
| D、工业上可以用电解法冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、既是氧化产物又是还原产物 |
| B、是氧化剂 |
| C、是还原剂 |
| D、既是氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com