
|
0.1 mol/L K2CO3溶液中,由于 | |
| [ ] | |
A. |
加入少量盐酸 |
B. |
加入适量水 |
C. |
加入适当KOH |
D. |
加热 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省孝感市高三第二次统考理综化学试卷(解析版) 题型:填空题
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g)?? △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g)????????????? △H = -566 kJ/mol
③H2O(l) = H2O(g)???? △H = + 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式???????????????????????????????????????????? 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) +? H2O(g) CO2(g) +? H2(g)
CO2(g) +? H2(g)
该反应的平衡常数与温度的关系如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O | CO | CO2 | H2 |
甲 (质量/g) | 1.8 | 8.4 | a | 1 |
乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是????????????????? ;达到平衡
时,乙容器中CO的转化率为???????? 。
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是???????????????????????????? 、??????????????????? (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ?????????? ??? ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = ?????????? 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = ?????????????????????? [用含c(HCO3-)、c(H2CO3)的符号表示]。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
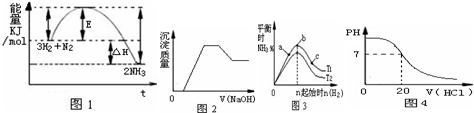
| A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小 |
| B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系 |
| C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响.可知反应物N2的转化率最高的是b点;T1>T2,K2>K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数) |
| D.图4表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1氨水的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |

①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和
20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1
NaHCO3溶液混合,实验测得产生的气体体积(V)
随时间(t)的变化如右图所示:反应初始阶段
两种溶液产生CO2气体的速率存在明显差异的原因是
。
反应结束后所得两溶液中,c(CH3COO—) c(SCN—)
(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。

a. c(CH3COO-) b. c(H+)
c. Kw d. 醋酸电离平衡常数
(2)右图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别
在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属
阳离子浓度变化情况。如果向三种沉淀中加盐酸,最
先溶解的是 (填化学式)。向新生成的ZnS浊液
中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS
沉淀会转化为 (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷
燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com