
【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝 的晶体类型是 ;
的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
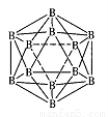
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方)  ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:简答题
6种相邻周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:

(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子 的气态氢化物甲是一种重要的化工原料。甲的电子式是 ,实验室制备甲的化学方程式是________, X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
下列物质之间的相互关系错误的是( )
A.CH3CH2OH和CH3OCH3互为同分异构体
B.干冰和冰为同一种物质
C.CH3CH3和CH3CH2CH3互为同系物
D.O2和O3互为同素异形体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
2011年,瑞士洛桑联邦工学院无理学家发现后用一种辉钼(MoS2)单分子层材料制造半导体,比传统硅材料和富勒烯更有优势。工业上用辉钼矿冶炼钼的化学原理:
①2MoS2+7O2 2MoO3+4SO2
2MoO3+4SO2
②MoO3+2NH3·H2O===(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl
④H2MoO4===MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排到空气中
B.MoO3不溶于氢氧化钠溶液
C.H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
B.0.5molC3H8分子中所含C-H共价键数为2NA
C.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA
D.1mol碳正离子CH5+所含的电子数为11NA
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:选择题
AlPO4的沉淀溶解平衡曲线如图所示(T2>T1。下列说法正确的是( )
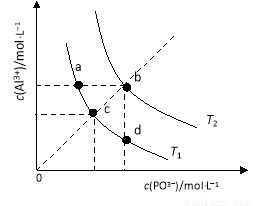
A.图像中四个点的Ksp:a=b>c> d
d
B.AlPO4在b点对应的溶解度大于c点
C.AlPO4(s) Al3+(aq)+PO43?(aq) △H<0
Al3+(aq)+PO43?(aq) △H<0
D.升高温度可使d点移动到b点
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:推断题
【化学一有机化学基础】已知:R-CH=CH-O-R′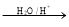 R-CH2CHO + R′OH(烃基烯基醚)烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
R-CH2CHO + R′OH(烃基烯基醚)烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
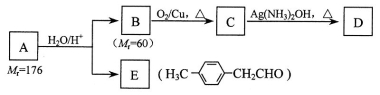
请回答下列问题:
(1) A的结构简式为_____________________、含有的官能团为 (写名称);
(2) E的名称是___________________;
(3) 写出C → D反应的化学方程式:_______________________________________。
(4) 同时满足下列条件的E的同分异构体有 种:K^S*5U.C#O
①属于芳香醛;② 苯环上有两种不同环境的氢原子。
其中核磁共振氢谱为5组峰的为其峰面积之比为3∶2∶2∶2∶1______________(写结构简式)
(5)由E转化为对甲基苯乙炔(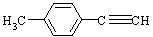 )的一条路线如下:
)的一条路线如下:

ⅰ. 写出G的结构简式:____________________________________。K^S*5U.C#O
ⅱ. 写出①~④步反应所加试剂、反应条件和反应类型:
序号 | 所加试剂及反应条件 | 反应类型 |
① | ||
② | ||
③ | ||
④ |
查看答案和解析>>
科目:高中化学 来源:2016届福建厦门外国语学校高三5月月考理综化学试卷(解析版) 题型:实验题
TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
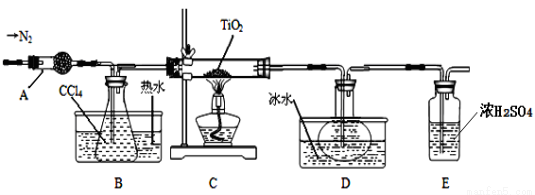
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行
B.某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行
C.反应方向是由焓变和熵变共同决定的,与反应温度无关
D.温度有可能对反应的方向起决定性作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com