
��������ʵ�У�ʲô����Ӱ���˻�ѧ��Ӧ�����ʣ�
��1������ƿ����H2��Cl2�Ļ�����壬��ƿ���ȼþ��ʱ������ը ��
��2������������ʱҪ�����ϸС�Ŀ��� ��
��3���ۻ���KClO3�ų����ݺ�������������MnO2��ܿ�������� ��
��4��ͬŨ�ȡ�ͬ����������з������ͬ����С��п����þ�飬���������п����� ��
��5����ȫ��ͬ��ʯ��ʯ�ֱ���0.1 mol/L�������1 mol/L�������з�Ӧ���ʲ�ͬ ��
��6�������ʳƷ�ױ�ù������Ͳ����������� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ�ص�����aW3+��bX+��cY2-��dZ-������ͬ�ĵ��Ӳ�ṹ��������������ȷ����
A����ԭ�ԣ� Z����Y2�� B��ԭ�Ӱ뾶��W��X ��Y��Z
C�����Ӱ뾶��Y2-��Z����X+��W3+ D��ԭ������d��c��b��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������˫Ѽɽһ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ʵ����
ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе����±���
���� | �״� | ������ | ��������� |
�е�/�� | 64.7 | 249 | 199.6 |
��.�ϳɱ���������ֲ�Ʒ
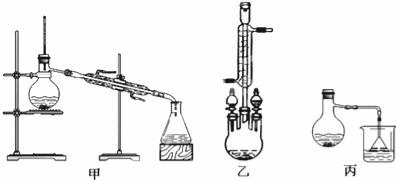
��Բ����ƿ�м���9.6ml(�ܶ�ԼΪ1.27g.ml-1)�������20mL�״����ܶ�Լ0.79g��mL��1������С�ļ���3mLŨ���ᣬ���Ⱥ�Ͷ�뼸�����Ƭ��С�ļ���ʹ��Ӧ��ȫ���ñ���������ֲ�Ʒ��
(1) �������Ƭ�������� ���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ����ʱ ������ȷ�𰸱�ţ���
A���������� B����ȴ�� C�����貹�� D����������
��2��Ũ����������� ���Һ��ʱ������Ũ��������ɣ� ��
��3���ס��ҡ�����λͬѧ�ֱ��������ͼ����ʵ���Һϳɱ����������װ�ã��г������ͼ�������������ȥ���������л���ķе���ò���װ�� ����ס����ҡ���������
��.�ֲ�Ʒ�ľ���
��4������������ֲ�Ʒ�к��������״������ᡢ�������ˮ���������������̽��о��ƣ����������ͼд���������������ƣ������� ��
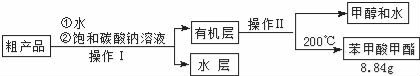
��5��������NaOH��Һ���汥��̼������Һ��ԭ���� ��
��6����ʽ���㣬����������IJ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������˫Ѽɽһ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ȳ�����ͼ�ȩ��ɵĻ�����У���ú�̼Ԫ�ص������ٷֺ���Ϊ72%������������Ԫ�ص������ٷֺ���Ϊ�� ��
A 22% B 20.7% C 28% D 24.9%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������˫Ѽɽһ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ϴ������������Ӧ���Թ�ʱ�����õ��Լ���( )
A����ˮ B��NaOH��Һ C������ D���ƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A��0.1 mol/L CH3COOH��Һ�У�c(CH3COO��)+c(CH3COOH)=0.1mol/L
B����Al2(SO4)3��Һ���ɣ����յ�Al2O3
C������FeCl3��Һ��Ӧ����������
D��Na2S��Һ�У�c(OH��)=c(H+) + c(HS��) + 2c(H2S)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ʵ���Ũ����ͬ��������Һ�У�NH4+Ũ��������
A��NH4Cl B��NH4HSO4 C��CH3COONH4 D��NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ�����߿���ǰģ��ʮ����ѧ�Ծ��������棩 ���ͣ�ʵ����
��ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪���ٷ�ӦC+G B+H�ܷų��������ȣ�GΪ����ɫ����I��һ�ֳ������������壬����E���Է�����Ӧ��2E+I
B+H�ܷų��������ȣ�GΪ����ɫ����I��һ�ֳ������������壬����E���Է�����Ӧ��2E+I 2F+D��F�е�EԪ�ص���������Ϊ60%���ش����⣺
2F+D��F�е�EԪ�ص���������Ϊ60%���ش����⣺
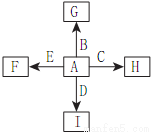
��1�����з�Ӧ�Ļ�ѧ����ʽΪ____________��
��2��1.6gG�������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ��������Ҫͭ��_________�ˡ�
��3��C�����NaOH��Һ��Ӧ�����ӷ���ʽΪ________����Ӧ�����Һ������Ļ�����I��Ӧ���ɳ��������ӷ���ʽΪ____________��
��4��E��I��Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ�����и������ۺ�ѵ��ʮ���ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
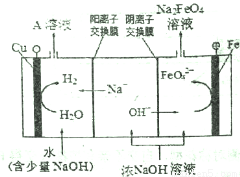
�������(K2FeO4)��һ�����͡���Ч�����ˮ��������������ɶ�����Ⱦ��
��֪�����������ȶ��Բ��ҵ����ʪ���Ʊ�������صĻ�����������ͼ��ʾ��
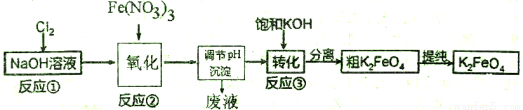
��1�����������������У�������Ӧ�����ӷ���ʽ��__________����ʵ��������һ����Ʒ�Ӧ�¶�30�����£���ԭ����__________��
�ڳ��������м���ŨKOH��Һ�������������(K2FeO4 )����˵��__________��
�����ᴿK2FeO4�в����ؽᾧ��ϴ�ӡ����º�ɵķ���������ϴ�ӷ�����__________��
��ij�¶��£���C12ͨ��NaOH��Һ�У���Ӧ��õ�NaCl��NaC1O��NaClO3�Ļ����Һ�����ⶨClO-��C1O3-���ӵ����ʵ���֮����1: 2����C12���������Ʒ�Ӧʱ������ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ__________��
��2����ҵ�ϻ�����ͨ�����ŨNaOH��Һ�Ʊ�Na2FeO4���乤��ԭ������ͼ��ʾ�������ĵ缫��ӦʽΪ__________�����п�ѭ��ʹ�õ�������__________��
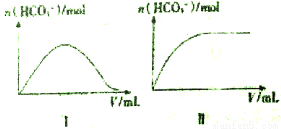
��3��CO2��ת��Ϊ̼���Σ�����Na2CO3��һ����;�㷺��̼����.��֪��25��ʱ��������ĵ���ƽ�ⳣ�����±���ʾ��

25��ʱ����һ��Ũ�ȵ�Na2CO3��Һ�зֱ��������ʵ���Ũ�ȵ�������Һ��������
��NaHSO3��HNO3��HC1O����Һ�е�n (HCO3-)����������Һ���(V)�Ĺ�ϵ����ͼ��ʾ�����з������ߢ����ҺΪ__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com