
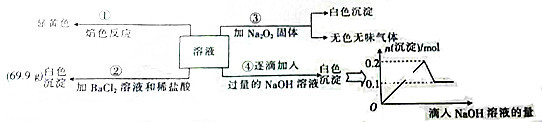
分析 溶液焰色反应呈黄色,说明溶液中含有Na+离子,溶液呈无色,则一定不含有色离子:Fe3+、Cu2+,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,判断一定无CO32-,图象分析可知,实验中生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,加入过氧化钠产生的是无色无味的气体,可以判定一定没有NH4+,可以推断一定含有Mg2+、Na+、Al3+,由于,Mg2+和 CO32- 不能共存,所以一定没有 CO32-,不能判断溶液中是否含有K+,据此进行解答.
解答 解:溶液焰色反应呈黄色,说明溶液中含有Na+离子,溶液呈无色,则一定不含有色离子:Fe3+、Cu2+,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,判断一定无CO32-,图象分析可知,实验中生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,加入过氧化钠产生的是无色无味的气体,可以判定一定没有NH4+,可以推断一定含有Mg2+、Na+、Al3+,由于,Mg2+和 CO32- 不能共存,所以一定没有 CO32-,不能判断溶液中是否含有K+,
(1)是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,焰色反应是物理变化,它并未生成新物质,焰色反应是物质原子内部电子能级的改变,通俗的说是原子中的电子能量的变化,不涉及物质结构和化学性质的改变,实验②中经过滤得到白色沉淀为硫酸钡沉淀,沉淀洗涤方法是取沉淀于过滤器的滤纸上,加入蒸馏水浸没沉淀,待蒸馏水自然流下,
故答案为:物理,取沉淀于过滤器的滤纸上,加入蒸馏水浸没沉淀,待蒸馏水自然流下;
(2)原溶液中一定存在的离子有Al3+、Na+、Mg2+、SO42-,可能存在K+,
故答案为:Al3+、Na+、Mg2+、SO42-,K+;
(3)实验③是过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和铝离子生成氢氧化铝沉淀,和镁离子生成氢氧化镁沉淀,反应中产生的白色沉淀的成分可能是Mg(OH)2、Al(OH)3,
故答案为:Mg(OH)2、Al(OH)3;
(4)依据图形变化可知,Mg2+物质的量为0.1mol,Al3+物质的量为0.1mol,SO42-离子物质的量等于硫酸钡沉淀物质的量=$\frac{69.9g}{233g/mol}$=0.3mol,溶液体积为100ml,若溶液中K+物质的量为0.04mol,依据电荷守恒计算c(K+)+c(Na+)+3c(Al3+)+2c(Mg2+)=2c(SO42-),c(Na+)=2×3mol/L-0.4mol/L-3×1mol/L-2×1mol/L=0.6mol/L,
故答案为:0.6mol/L.
点评 本题考查了离子性质、离子检验和离子反应现象的分析判断,注意离子反应现象和溶液中离子物质的量的确定,图象的分析计算,电荷守恒计算是解题关键,题目难度中等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 分离方法 | 原理 |
| A | 除去CO2中的HCl | 通入饱和Na2CO3溶液 | HCl和Na2CO3溶液反应生成CO2 |
| B | 除去乙醇中少量的乙酸 | 加入足量生石灰蒸馏 | 乙醇和乙酸钙的沸点相差较大 |
| C | 除去KNO3固体中NaCl | 冷却热饱和溶液重结晶 | NaCl在水中的溶解度很大 |
| D | 分离乙酸和乙醇 | 用分液漏斗分液 | 乙醇乙酯和乙醇的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO中混有的少量O2:通过灼热的Cu网后收集气体 | |
| B. | 除去SO2中混有的CO2:可通过盛有KMnO4溶液的装置洗气 | |
| C. | 除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置 | |
| D. | 除去SiO2中的Fe2O3:可加入NaOH溶液后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热NaHCO3制取和收集CO2 | |
| B. | 用铜和稀硝酸反应制取和收集NO | |
| C. | 用NH4Cl与浓NaOH溶液反应制取和收集NH3 | |
| D. | 用铜和浓硝酸反应制取和收集NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浅黄色固体 | B. | 应密封保存 | ||
| C. | 与CO2反应时,CO2作还原剂 | D. | 与H2O反应时,放出大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com