
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为____________________________;
(2)A中的碳原子是否都处于同一平面?_________(填“是”或者 “否”);
(3)A是否存在顺反异构体?_________(填“是”或者“否”)。
(4)用系统命名法命名A为______________________;
【答案】
(1)![]()
(2)是
(3)否
(4)2,3-二甲基-2-丁烯
【解析】
试题分析:由题意可知某烃类化合物A的质谱图表明其相对分子质量为84,设A的分子式为CxHy,由84/12=7可知,只有x=6,y=12时成立;红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子,所以A的结构简式为:![]() 。
。
故答案为:![]() ;
;
(2)因为以碳碳双键为中心的6个原子共平面,所以A分子中6个C原子一定在同一平面内。
故答案为:是;
(3)当碳碳双键的两个碳原子都分别与两个不同的原子或原子团相连时,该分子存在顺反异构,结构简式可知A不符合条件。
故答案为:否;
(4)由A的结构简式可知,该分子的系统名称应为:2,3-二甲基-2-丁烯。
故答案为:2,3-二甲基-2-丁烯。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如右图所示。
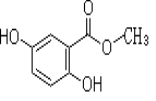
回答以下问题:
(1)龙胆酸甲酯所含官能团名称为 _________________
(2)龙胆酸甲酯的分子式为________________
(3)下列有关龙胆酸甲酯的描述,正确的是______________(填字母)。
a.能发生消去反应
b.能与氢气发生加成反应
c.能与浓溴水反应
(4)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式___________________ 。
(5)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_________、____________。
① 能发生银镜反应; ② 能使FeCl3溶液显色;
③ 酯类 ④苯环上的一氯代物只有两种
(6)已知X及其它几种有机物存在如下转化关系,且测得C4H8含有一个支链,A的核磁共振氢谱图中有两个吸收峰。
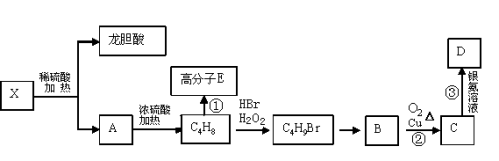
写出①的化学方程式____________________________________。
②的化学方程式______________________________________。
③化学方程式 ________________________________________。
写出X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理_______说明理由:_____________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
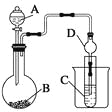
(3)仪器A的名称为____,干燥管D的作用是______________。
(4) 实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________,离子方程式为____________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气.
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加________,观察到C中溶液的现象为____________________。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应:
①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。
(1)属于复分解反应的放热反应的是____________________________。(用序号填空)
(2)属于吸热反应的是_____________________________________________。(用序号填空)
(3)能设计成原电池的反应是_______________________________________。(用序号填空)
(4)能设计成燃料电池的反应是_____________________________________。(用序号填空)
(5) 写出③发生反应的化学方程式___________________________________。
写出④发生反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C10H20O2)具有兰花香味,可用做香皂、洗发香波的芳香赋予剂。
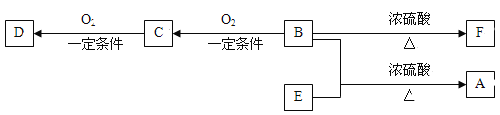
已知:①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)。
a、取代反应 b、消去反应 c、加聚反应 d、氧化反应
(2)C、D、F分子所含的官能团的名称依次是
(3)写出E的结构简式:
(4)写出C→D的化学方程式:
(5)写出B→F的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
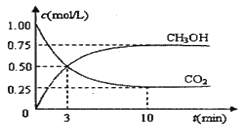
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
(2)该反应的平衡常数为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为: ;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液![]() mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液![]() mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图只表示出与反应有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。
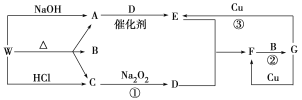
(1)化合物W可能是________或__________(填化学式),C的结构式是________,
(2)D的组成元素在周期表中的位置是__________。
(3)反应③的离子方程式:________________________。
(4)已知在催化剂作用下,E与CO反应生成参与大气生态循环的无毒物质,请写出该反应的化学方程式 。
(5)在反应②中,发生还原反应和氧化反应的物质的质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围? 。
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100 mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O/span>;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。(写出具体计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com