
【题目】已知40℃时水的离子积常数为Kw。该温度下, 将浓度为 a mol/L的一元酸HA与 b mol/L的一元碱BOH等体积混合,该溶液呈中性时,下列叙述不正确的是
A. a=b,pH=7
B. 混合溶液的c(H+)=c(OH-)
C. 混合溶液中,c(B+) =c(A-)
D. 混合溶液中,c(OH-)= ![]() mol/L
mol/L
【答案】A
【解析】一元酸HA若为弱酸,a=b,酸碱恰好完全反应,生成弱酸强碱盐,水解显碱性;若一元酸HA若为强酸,a=b,酸碱恰好完全反应,生成强酸强碱盐,溶液呈中性,但是溶液的pH<7,因为温度为40℃时水的离子积常数为Kw, A错误;任何温度下,混合液呈中性,就满足c(H+)=c(OH-);B正确;根据电荷守恒规律:c(H+)+ c(B+)= c(A-)+ c(OH-),如果c(H+)=c(OH-),则c(B+) =c(A-),C正确;溶液中:c(H+)×c(OH-)=Kw,该溶液呈中性时,c(H+)=c(OH-),所以c(OH-)= ![]() mol/L,D正确;正确答案选A。
mol/L,D正确;正确答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
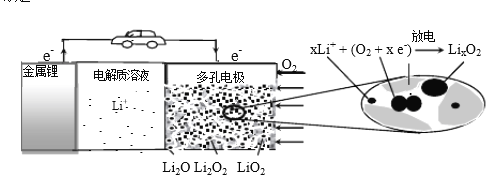
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1 , 合闭K2、K3通直流电,回答下列问题: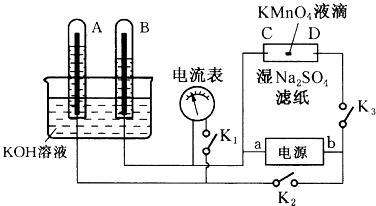
(1)判断电源的两极,a为极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,过一段时间,现象为。
(3)若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3 , 合闭K1 , 则电流表的指针(填是或否)偏转;若偏转,则此时A极电极反应式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A.过滤时,玻璃棒与三层滤纸
B.用量筒从食盐溶液中量出4.3 mL溶液
C.过滤时,烧杯内壁与漏斗下端
D.用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+nB(g) ![]() pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。
pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。
(1)用“>”、“=”或“<”填空:该反应的ΔH______0,m+n______p。
(2)用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入B,则A的转化率________;升高温度,则平衡时B、C的浓度之比c(B)/c(C)将________;加入催化剂,平衡时气体混合物的总物质的量________。
(3)若A、C均为无色气体,B为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入C,平衡混合物的颜色________;而恒压充入氖气,平衡混合物颜色________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Zn + CuSO4 ═ Cu + ZnSO4 设计一个原电池。
(1) 在下面方格内画出实验装置图________.

(2)指出正极材料可以为_____________, 电极反应式是_______________;负极材料为_____________,电极反应式是_____________________________.
(3)若反应过程中有0.2mol电子通过,则溶解Zn的质量为________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com