
| A. | 32gO2和32gO3所含分子数目都为NA | |
| B. | 标准状况下,11.2 L水中含有的原子数是1.5NA | |
| C. | 0.1mol Fe参与化学反应转移的电子数一定为0.3NA | |
| D. | 标准状况下,5.6L氯气和16.8L氧气混合气体中含有的分子数为NA |
分析 A、氧气和臭氧的摩尔质量不同;
B、标况下水为液态;
C、铁反应后可能变为+2价或+3价;
D、求出混合物气体的物质的量,然后根据分子个数N=nNA来计算;
解答 解:A、氧气和臭氧的摩尔质量分别为32g/mol和48g/mol,故32g氧气和臭氧的物质的量之比为48:32=3:2,则分子数之比为3:2,故A错误;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、铁反应后可能变为+2价或+3价,故0.1mol铁反应后转移的电子数可能为0.2mol,也可能为0.3mol,故C错误;
D、混合物气体的体积为22.4L,故在标况下混合物气体的物质的量为1mol,分子个数N=nNA=NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.005 mol | B. | 0.03 mol | C. | 0.02 mol | D. | 0.01 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| B. | Fe3O4与过量的稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl2、漂白液在生产、生活中广泛用于杀菌、消毒.回答下列问题:
Cl2、漂白液在生产、生活中广泛用于杀菌、消毒.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金的质量为0.92g | B. | 图中V2为60 | ||
| C. | 整个滴定过程Na+的浓度保持不变 | D. | 合金中Na与Al物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
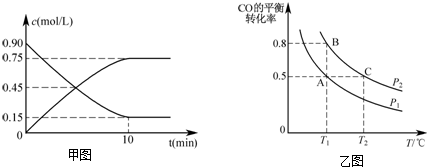
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | 等物质的量的溴化亚铁与氯气2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 小苏打与甲酸溶液混合H++CO32-+HCOOH=CO2↑+HCOO-+H2O | |
| D. | 澄清石灰水中滴加少量碳酸氢钙溶液Ca2++OH-+HCO3-=H2O+CaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com