
分析 (1)水电离时吸热过程,升温平衡正向进行,氢离子浓度增大;PH减小;
(2)弱酸性或中性条件下,铁、碳棒和电解质溶液构成原电池,铁发生吸氧腐蚀,C作正极发生还原反应,据此分析解答;
(3)碳酸氢根离子为弱酸的酸式根离子水解生成碳酸和氢氧根离子;碳酸氢钠与NaHSO4反应生成硫酸钠、二氧化碳气体和水,碳酸氢根离子不能拆开;
(4)计算该情况下浓度商Qc,与平衡常数比较判断,若Qc=k,处于平衡状态,若Qc<k,反应向正反应进行,Qc>k,反应向逆反应进行;化学平衡常数K等于生成物的浓度幂之积除以反应物的浓度幂之积,只与温度有关;将容器缩小体积,平衡向体积缩小的方向移动;
(5)根据电子守恒以及原子守恒知识来回答.
解答 解:(1)水电离时吸热过程,升温平衡正向进行,氢离子浓度增大,95℃纯水中c(H+)>10-7 mol•L-1,常温纯水PH=7,水电离时吸热过程,升温平衡正向进行,溶液PH减小,95℃纯水的pH小于7,
故答案为:>;<;
(2)氯化钠溶液呈中性,中性条件下,Fe、C和NaCl溶液构成原电池,Fe易失电子作负极、C作正极,Fe发生吸氧腐蚀,负极、正极反应式分别为Fe-2e-=Fe2+、O2+4e-+2H2O=4OH-,
故答案为:O2+4e-+2H2O=4OH-;
(3)NaHCO3溶液中碳酸氢根离子水解生成氢氧根离子,离子方程式:HCO3-+H2O?H2CO3+OH-,溶液呈碱性,碳酸氢钠与NaHSO4反应生成硫酸钠、二氧化碳气体和水,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,
故答案为:碱性;HCO3-+H+=CO2↑+H2O;
(4)该温度下向10L密闭容器中加入0.06mol SO2、0.04mol O2和0.4mol SO3,浓度商Qc=$\frac{{c}_{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.{4}^{2}}{0.0{6}^{2}×0.04}$≈1111<K=6.7×103,反应不处于平衡状态,平衡正向移动,由于反应2SO2(g)+O2(g)?2SO3(g)△H<0,正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,将容器体积缩小一半,平衡向体积缩小的方向移动,即正向移动,
故答案为:正;减小;正向;
(5)碘离子被氧化为碘单质时,所有的碘元素化合价升高了2价,消耗碘离子是2mol,亚硝酸钠中氮元素化合价是+3价,2mol的亚硝酸钠得到2mol电子时,
则需氮元素的化合价降为+2价,所以产物中含氮的物质为NO,所以此反应的例子方程式为:4H++2NO2-+2I-=2NO↑+I2+2H2O,
故答案为:4H++2NO2-+2I-=2NO↑+I2+2H2O.
点评 本题考查较为综合,涉及水的电离平衡影响因素分析、PH计算分析判断、电化学腐蚀、化学平衡、离子反应等知识,注意高频考点理解平衡常数的用途:判断反应进行的程度、判断反应的热效应、判断反应进行的方向,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
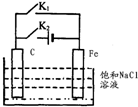
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①是BaCl2溶液,②稀盐酸 | B. | ①是稀盐酸,②稀BaCl2溶液 | ||
| C. | ①是稀硝酸,②是AgNO3溶液 | D. | ①是稀硫酸,②是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 含氢量:甲烷>乙烯>乙炔>苯 | |
| C. | 密度:CCl4>CHCl3>苯>H2O | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.02 mol•L-1 | D. | 0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
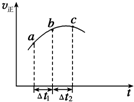 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )| A. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物浓度:a点小于b点 | |
| D. | 反应在C点达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com