
| 实验编号 | 预期的转化 | 选择的试剂 | 实验现象 | 结论(用化学方程式表示) |
| ① | S→SO2 | 硫磺、 氧气 | -- | |
| ② | SO2→S | 二氧化硫、 硫化氢 | --- | SO2+2H2S═3S↓+2H2O |
| ③ | SO2→H2SO4 | 二氧化硫、 氯水 | 氯水退色 | |
| ④ | H2SO4→SO2 | -- |
| ① | 蓝紫色火焰 | |||
| ② | ||||
| ③ | SO2+Cl2+2H2O=H2SO4+2HCl | |||
| ④ | 铜片、浓硫酸 | Cu+2H2SO4═CuSO4+SO2↑+2H2O |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、XY3 |
| B、XY |
| C、X3Y |
| D、X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
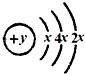 ;F的最外层电子数是电子层数的2倍.
;F的最外层电子数是电子层数的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:
| 探究内容 | 实验方案 | 实验现象 |
| 探究 Fe 2+ 具有还原性 | ||
| 探究 Fe 2+ 具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y的单质存在Y2、Y3两种同素异形体 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置制备氧气并进行相关实验探究.
利用如图所示装置制备氧气并进行相关实验探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com