
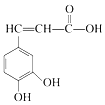
| A. | 与咖啡酸的物质类别完全相同(含咖啡酸),且苯环上只有3个取代基的同分异构体(包括顺反异构)有18种 | |
| B. | 1mol咖啡酸最多可与3molBr2反应 | |
| C. | 咖啡酸与 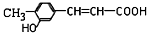 互为同系物 互为同系物 | |
| D. | 1mol咖啡酸与足量NaHCO3溶液反应产生3mol气体 |
分析 由咖啡酸的结构简式 可知,其分子中含2个酚-OH、1个碳碳双键和1个-COOH,结合酚、烯烃、羧酸的性质及同系物的概念、同分异构体的书写原则进行解答.
可知,其分子中含2个酚-OH、1个碳碳双键和1个-COOH,结合酚、烯烃、羧酸的性质及同系物的概念、同分异构体的书写原则进行解答.
解答 解:A.与咖啡酸的物质类别完全相同(含咖啡酸),且苯环上只有3个取代基的同分异构体,说明苯环侧链为2个-OH、1个-CH=CHCOOH或-C(COOH)=CH2,
当侧链为2个-OH、1个-CH=CHCOOH(存在顺反异构)时,苯环侧链3个取代基可能组合有:①3个取代基都在间位,有1种结构,②3个取代基都在邻位,有2种结构,③3个取代基中只有2个相邻,2个-OH相邻的有1种结构,1个-OH和-CH=CHCOOH相邻时有2种结构,所以有1+2+1+2=6种结构,同时满足有机物都存在顺反异构,总共有6×2=12种结构;
当侧链为2个-OH、1个-C(COOH)=CH2(不存在顺反异构)时,苯环侧链3个取代基可能组合有:①3个取代基都在间位,有1种结构,②3个取代基都在邻位,有2种结构,③3个取代基中只有2个相邻,2个-OH相邻的有1种结构,1个-OH和-C(COOH)=CH2相邻时有2种结构,总共有1+2+1+2=6种结构,
所以满足体积的有机物总共有12+6=18种结构,故A正确;
B.含双键与溴水发生加成反应,含酚-OH,酚-OH的邻对位与溴水发生取代反应,所以1mol该有机物最多消耗4mol溴单质,故B错误;
C.咖啡酸中含有两个酚羟基,而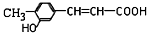 分子中含有1个酚羟基,二者结构不相似,不属于同系物,故C错误;
分子中含有1个酚羟基,二者结构不相似,不属于同系物,故C错误;
D.只有官能团-COOH与NaHCO3溶液反应生成二氧化碳,1mol该有机物分子中含有1mol羧基,最多产生1mol二氧化碳,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,题目难度中等,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、烯烃性质的考查,A为易错点,注意掌握同分异构体的书写原则.


科目:高中化学 来源: 题型:选择题
| A. | 偏二甲肼(C2H8N2)的摩尔质量为60g | |
| B. | 火箭发射时,偏二甲肼(C2H8N2)燃烧生成CO2、N2、H2O | |
| C. | 偏二甲肼(C2H8N2)中所有原子最外层都达到8个电子 | |
| D. | 从能量变化看,主要是化学能转变为热能和动能,它是一种能量很高的烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
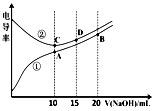
| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 草酸二酯的分子中所有碳原子一定共平面 | |
| B. | 草酸二酯水解后生成醇的分子式为C5H12O | |
| C. | 草酸二酯中苯环上氢原子被一个溴原子取代的有机产物有两种 | |
| D. | 1 mol草酸二酯与足量NaOH溶液反应最多消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 为防止食品氧化变质,常在食品包装袋中放入生石灰 | |
| C. | 用加热灼烧的方法可以区分羊毛毛线和腈纶毛线 | |
| D. | 加快开发髙效洁净能源转换技术,缓解能源危机 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
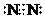
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
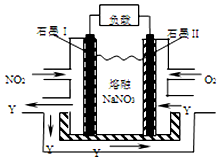 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com