
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |
分析 A.一种物质组成的为纯净物,不同物质组成的为混合物;
B.和酸反应生成盐和水的氧化物为碱性氧化物;
C.盐是一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物;
D.水溶液中或熔融状态下导电的化合物为电解质;水溶液中和熔融状态下都不导电的化合物为非电解质.
解答 解:A.水银、氢氧化铁固体由一种物质组成,为纯净物,冰水混合物是一种习惯性叫法,实质上就是一种物质水,是纯净物,故A正确;
B.能和酸反应生成盐和水的氧化物为碱性氧化物,而过氧化钠与酸反应除生成盐和水以外还有氧气,所以过氧化钠不是碱性氧化物,氧化铝是两性氧化物,故B错误;
C.烧碱是氢氧化钠,属于碱,故C错误;
D.氨气不能自身电离而导电,所以不是电解质,应是非电解质,故D错误;
故选A.
点评 本题考查纯净物、碱性氧化物、盐、电解质等概念,难度不大,注意这几个概念的区别和平时的积累.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:填空题
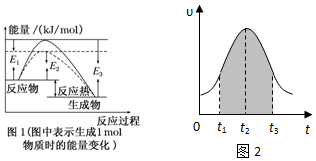
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
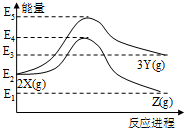
| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 由X→Z反应的△H>0 | |
| C. | 由图可知等物质的量的Y的能量一定比X的能量高 | |
| D. | 升高温度可提高X→Z的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应为吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$ | |
| C. | 其他条件不变时,增大体系的压强,化学平衡常数减小 | |
| D. | 单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
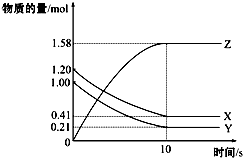 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 在前10s内用X、Y、Z表示的反应速率数值相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com