
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
分析 n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,根据转移电子守恒得生成n( H2)=$\frac{0.2mol×3}{2}$=0.3mol,说明Al恰好完全反应,发生的反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据系数比确定反应的氢氧化钠质量,从而确定溶液中剩余氢氧化钠质量,再根据质量分数公式计算即可,
解答 解:n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,根据转移电子守恒得生成n( H2)=$\frac{0.2mol×3}{2}$=0.3mol,说明Al恰好完全反应,发生的反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式知,0.2molAl完全反应消耗氢氧化钠0.2mol,m(NaOH)=0.2mol×40g/mol=8g<40g,所以氢氧化钠有剩余,则百分比浓度大于或等于$\frac{8g}{40g}$×100%≥20%,故选D.
点评 本题考查化学方程式的有关计算,为高频考点,正确判断各个物理量关系是解本题关键,注意过量计算,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸、烧碱、氯酸钾、过氧化钠分别属于酸、碱、盐、碱性氧化物 | |
| B. | PM2.5指大气中直径接近于2.5×10-6 m的颗粒物,PM2.5在空气中形成胶体 | |
| C. | 氯气的水溶液能导电,因此氯气属于电解质 | |
| D. | 反应8NH3+3Cl2═N2+6NH4Cl中,氧化剂与还原剂物质的量之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
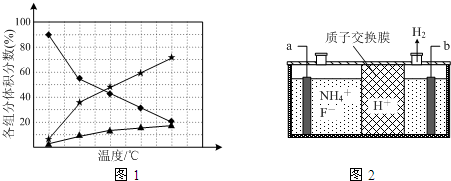
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
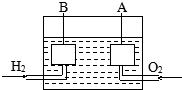 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 (1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下c(NH4+)相同的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,物质的量浓度由大到小的顺序为②>①>③ | |
| B. | 0.001mol•L-1氯水中:c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=0.01mol•L-1 | |
| C. | amol•L-1的醋酸与0.01mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=5×10-10/(a/2-0.005) | |
| D. | 向5mL含KCl和Kl浓度均为0.01mol•L-1的混合溶液中,滴加8mL0.01mol•L-1的AgNO3溶液,所得溶液中离子浓度大小关系为c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com