
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
考点: 化学反应的可逆性.
专题: 化学平衡专题.
分析: 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答: 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X2(气)+Y2(气)  2Z(气),
2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应向逆反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+Y2(气)  2Z(气),
2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
 由于为可能反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4
由于为可能反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4
故A正确、BCD错误.
故选:A.
点评: 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某有机物A(C4 H6O5),广泛存在于许多水果中,是一种常用的食品添加剂.该化合物具有如下性质:
i.25℃时,电离常数K1=3.99×10﹣4,K2=5.5×10﹣6
ii.Imol A与足量钠产生1.5mol H2;
ii.分子中核磁共振氢谱显示有5种不同化学环境的氢原子.与A相关的反应流程如下:
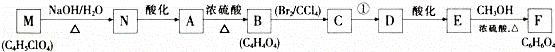
回答下列问题:
(1)A中官能团的名称为 ;B的结构简式为 ,C的系统命名为 _.
(2)A﹣﹣B的反应类型为消去反应;反应①所需的反应条件为 .
(3)写出下列反应的化学方程式:
①M﹣N. ;
②E﹣F. ,
(4)A有多种同分异构体,写出符合下列条件的同分异构体结构简式: .
①能发生水解,生成两种有机物;②水解后产物之间能发生缩聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 等量H2在 O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同
O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
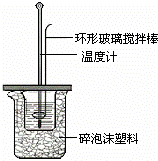
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器 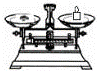

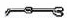


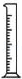
序号 a b c d e f
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2﹣t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 4.0
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H= (取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 生成物的总能量一定低于反应物的总能量
B. 分解反应一定是吸热反应
C. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:mA(g)+nB(g)⇌pC(g)△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是()
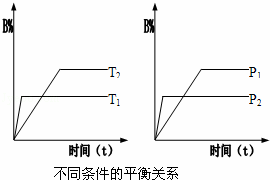
A. T1<T2,p1>p2,m+n<p,△H>0 B. T1>T2,p1<p2,m+n<p,△H<0
C. T1>T2,p1<p2,m+n>p,△H>0 D. T1>T2,p1>p2,m+n>p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
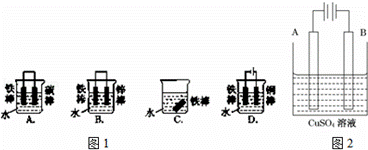
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
(1)图1哪个装置可防止铁棒被腐蚀BD.
(2)在实际生产中,可在铁 件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
①A电极对应的金属是铜(写元素名称),B电极的电极反应式是 .
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应热的说法正确的是()
A. 当△H<0时,表示该反应为吸热反应
B. 已知C(s)+ O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
当物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液中所含Cl﹣的个数相等时,这三种溶液的体积比应是()
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 6:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com