
| A. | 溶液X中存在大量Mg2+ | |
| B. | 溶液X中一定存在K+ | |
| C. | 溶液X中c(CO32-)=0.02mol•L-1 | |
| D. | 溶液X中一定存在NH4+、Cl-、CO32-、SO42- |
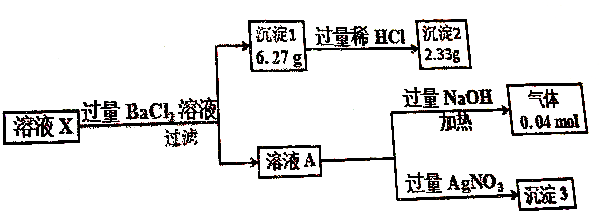
分析 溶液X加入过量氯化钡溶液生成沉淀1质量为6.27g沉淀,且沉淀部分溶液稀盐酸,说明原来有CO32-,则原溶液中没有Mg2+、Ba2+,沉淀没有完全溶解,说明原溶液中有SO42-,且BaSO4的质量为2.33g,则说明原溶液中SO42-的物质的量为0.01mol,BaCO3的质量为6.27g-2.33g=3.94g,为0.02mol,溶液加入NaOH溶液生成0.04mol气体,为氨气,说明含有0.04molNH4+,加入硝酸银生成白色沉淀,为AgCl,因加入氯化钡,则不能证明含有Cl-,结合电荷守恒确定是否含有K+,以此解答该题.
解答 解:溶液X加入过量氯化钡溶液生成沉淀1质量为6.27g沉淀,且沉淀部分溶液稀盐酸,说明原来有CO32-,则原溶液中没有Mg2+、Ba2+,沉淀没有完全溶解,说明原溶液中有SO42-,且BaSO4的质量为2.33g,则说明原溶液中SO42-的物质的量为0.01mol,BaCO3的质量为6.27g-2.33g=3.94g,为0.02mol,溶液加入NaOH溶液生成0.04mol气体,为氨气,说明含有0.04molNH4+,加入硝酸银生成白色沉淀,为AgCl,因加入氯化钡,则不能证明含有Cl-,CO32-、SO42-所带负电荷为0.01mol×2+0.02mol×2=0.06mol,含有0.04molNH4+,由电荷守恒可知一定含有K+,
A.由以上分析可知一定不含镁离子,故A错误;
B.由电荷守恒可知一定含有K+,故B正确;
C.溶液X中c(CO32-)=$\frac{0.02mol}{0.1L}$=0.2mol/L,故C错误;
D.因加入氯化钡,则不能证明含有Cl-,故D错误.
故选B.
点评 本题考查无机物的推断,为高频考点,把握实验中发生的反应、现象与结论的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 与足量盐酸反应放出气体 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与氯化钙溶液不反应 | D. | 溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为1NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA | |
| C. | 常温常压下,22.4L CO2气体含有原子数为3NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 需区分的物质 | 实验方法 |
| A | 白酒和白醋 | ①观察颜色②闻气味 |
| B | 食盐和白糖 | ①加稀盐酸②加水溶解 |
| C | 合成纤维和天然纤维 | ①点燃闻气味②观察色泽 |
| D | 酸性厕所清洁剂与碱性厨房清洁剂 | ①测pH②加石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
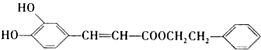 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
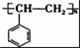 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.03×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
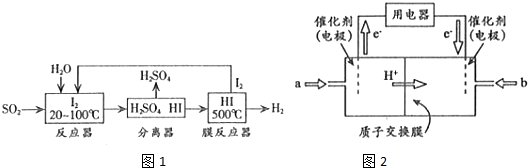
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
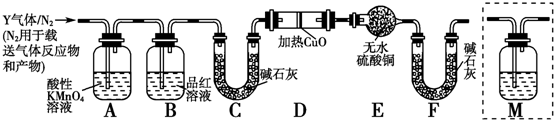
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
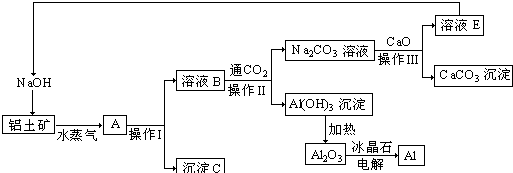
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com