
| A. | 用分液漏斗分离乙醇和乙酸乙酯的混合物 | |
| B. | 新制氯水或浓硝酸存放在带橡皮塞的棕色玻璃瓶中 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 加热蒸发NaCl溶液时应用玻璃棒不断搅拌 |
分析 A.乙酸乙酯易溶于乙醇,混合液不分层;
B.硫酸和浓硝酸具有强氧化性,能够氧化橡皮塞;
C.氢氧化钠具有腐蚀性,会腐蚀皮肤;
D.为了使溶液受热均匀,蒸发氯化钠溶液时需要用玻璃棒搅拌.
解答 解:A.乙醇和乙酸乙酯不分层,无法用分液漏斗分离乙醇和乙酸乙酯的混合物,故A错误;
B.硫酸和浓硝酸能够氧化橡皮塞,新制氯水或浓硝酸存不能放在带橡皮塞的玻璃瓶中,应该选用玻璃塞,故B错误;
C.浓硫酸溅到皮肤上时,用稀氢氧化钠溶液冲洗会腐蚀皮肤,应该用稀的碳酸氢钠溶液冲洗,故C错误;
D.加热蒸发NaCl溶液时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液体飞溅,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,涉及分液、试剂保存、蒸发、安全事故处理等知识,明确常见化学实验基本操作方法为解答关键,试题有利于提高学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
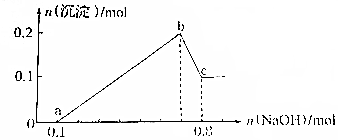 某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示
某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 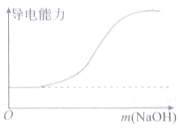 |
| A.向100mL 0.1mol•L-1H2SO4溶液中滴加 0.1mol•L-1Ba(OH)2溶液至过量 | B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 |
 |  |
| C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展电动车,减少燃油汽车的尾气排放量 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
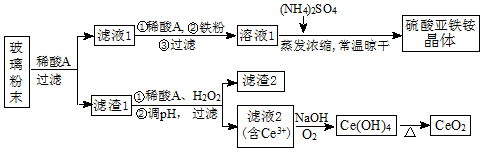
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com