
【题目】已知漂白粉与浓盐酸反应可产生氯气,某同学试图测定氯气的体积并验证干燥纯净的氯气无漂白性,现有如下装置,请回答:
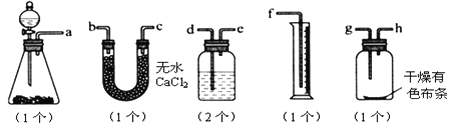
(1)请用字母填写装置的连接顺序:
a 接( ),( )接( ),( )接( ),( )接( ),( )接( )。
(2)洗气瓶中所装液体是 。
(3)在制氯气前,必须进行的一项操作步骤是 。
(4)某同学实验时,发现量筒中未收集到液体,则失败的原因可能是 。
(5)写出漂白粉与浓盐酸反应制氯气的化学方程式 。
【答案】(1)(d)(e);(b 或 c);(c 或 b);(g);(h)(e);(d);(f);
(2)饱和食盐水;(3)检查装置的气密性;
(4)盐酸浓度小,反应没发生;装置漏气;e 与 f 连接.
(5)Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
【解析】
试题分析:(1)本实验有两个目的,其一是验证干燥的氯气没有漂白性;其二是测量氯气的体积,由于测量氯气的体积是根据排入量筒里的水来读出,所以验证干燥的氯气无漂白性的实验必须放在测量氯气的体积之前,所以其连接顺序为:发生装置→除氯化氢装置→除水蒸气→验证漂白性→排液体→收集液体,除去水蒸气可以用装有无水CaCl2的U型管,也可以用盛有浓硫酸的洗气瓶,则连接顺序是(d)(e);(b 或 c);(c 或 b);(g);(h)(e);(d);(f);。
(2)Cl2在饱和食盐水中的溶解度小(有时也用水代替),可除去Cl2中混有的HCl,所以洗气瓶中所装液体为饱和食盐水。
(3)任何气体的制备实验开始之前,都必须检查装置的气密性。
(4)最后由量筒和洗气瓶组成的“量气装置”,可以粗略地测定Cl2的体积,若量筒中未收集到液体,则失败的原因可能是盐酸浓度小,反应没发生;装置漏气;e 与 f 连接。
(5)漂白粉的主要成分是CaCl2和Ca(ClO)2,Ca(ClO)2与浓盐酸反应生成氯气、CaCl2和水,反应的化学方程式为Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )

A. 该有机物能与溴水发生加成反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol 该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
叙述I | 叙述II | |
A | 氯气具有强还原性 | 可用于自来水的消毒杀菌 |
B | SiO2导电能力强 | 可用于制造太阳能电池板 |
C | SO2有还原性 | SO2能使酸性KMnO4溶液褪色 |
D | 盐酸和氨水都能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同状况下的下列气体分别充满一干燥烧瓶中,把烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度大小关系为
①NH3;②NO2;③体积比4:1混合的NO2和O2;④NO(用导管向烧瓶中缓缓通入O2至气体恰好完全吸收)
A.①=②>③>④
B.①=②=③=④
C.①=②=④>③
D.①>③>②>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1L1 molL-1的NH4Cl溶液进行如下操作,溶液的pH增大的是( )
A.加热
B.加入少量的NH4Cl固体
C.加水稀释
D.再加1L 1molL NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,使NO2和O2按4:1体积比充满干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度为( )
A.1/14mol/L B.4/5mol/L C.1/28mol/L D.1/42mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各题所给出的数据,得出的结论正确的是
A. 通入标准状况下HC1气体11.2L,可使1L浓度为0.5 mol·L-1的盐酸浓度增大到1 mol·L-1
B. 在10%的NaOH溶液中,平均每9个水分子溶有1个OH-
C. 将10 g碳酸钙粉末加水配成100 mL溶液,CaCO3物质的量浓度为1 mol·L-1
D. 4gNaOH溶解在l0mL水中,再稀释成1L,从中取l mL,这lmL溶液的浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列广告语在科学性上没有错误的是( )
A. 没有水就没有生命
B. 这种饮料不含任何化学物质
C. 这种纯净水绝对纯净,不含任何离子
D. 这种口服液含有丰富的N、P、Zn等微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同
D.无论哪种类型的腐蚀,其实质都是金属被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com