
”¾ĢāÄæ”æŹµŃéŹŅÓĆŗ¬ÓŠŌÓÖŹ£ØFeO”¢Fe2O3£©µÄ·ĻCuOÖʱøµØ·Æ¾§Ģ壬¾ĄśĮĖĻĀĮŠ¹ż³Ģ£ØŅŃÖŖ Fe3+ŌŚ pH=5Ź±³ĮµķĶźČ«£©£®ĘäÖŠ·ÖĪö“ķĪóµÄŹĒ

A. ²½Öč¢Ś·¢ÉśµÄÖ÷ŅŖ·“Ó¦ĪŖ£ŗ2Fe2++H2O2+2H+=2Fe3++2H2O
B. ²½Öč¢Ś²»ÄÜÓĆĀČĖ®”¢ĻõĖįµČĒæŃõ»Æ¼Į“śĢęH2O2
C. ²½Öč¢ÜĪŖ¹żĀĖ£¬²½Öč¢ŻÕō·¢½į¾§
D. ²½Öč¢ŪÓĆ CuCO3“śĢęCuOŅ²æɵ÷½ŚČÜŅŗµÄpH
”¾“š°ø”æC
”¾½āĪö”æ
A. ²½Öč¢ŚĪŖŃĒĢśĄė×ÓÓė¹żŃõ»ÆĒāµÄŃõ»Æ»¹Ō·“Ó¦£¬Ąė×Ó·“Ó¦ĪŖ2Fe2++H2O2+2H+=2Fe3++2H2O£¬¹ŹAÕżČ·£»
B. Čō²½Öč¢ŚÓĆĀČĖ®”¢ĻõĖįµČĒæŃõ»Æ¼Į“śĢęH2O2£¬ŅżČėŌÓÖŹĀČĄė×Ó”¢ĻõĖįøłĄė×ÓµČ£¬ÄŃŅŌ³żČ„£¬Ķ¬Ź±»įÉś³ÉNOĘųĢ壬ĖłŅŌ²½Öč¢Ś²»ÄÜÓĆĀČĖ®”¢ĻõĖįµČĒæŃõ»Æ¼Į“śĢęH2O2£¬¹ŹBÕżČ·£»
C. ²½Öč¢ÜĪŖ¹żĀĖ£¬ĮņĖįĶČÜŅŗ”śĮņĖįĶ¾§Ģå²½ÖčÓ¦øĆĪŖÕō·¢ÅØĖõ”¢ĄäČ“½į¾§£¬²»ŹĒÕō·¢½į¾§£¬ĖłŅŌ²½Öč¢ŻÕō·¢½į¾§“ķĪ󣬹ŹC“ķĪó£»
D. CuCO3ŗĶCuO¶¼ÓėČÜŅŗÖŠH+·“Ó¦£¬Ęšµ½µ÷½ŚČÜŅŗpHµÄ×÷ÓĆ£¬²¢²»ŅżČėŠĀµÄŌÓÖŹ£¬¹ŹDÕżČ·£»


 ÖĒ»ŪŠ”ø“Ļ°ĻµĮŠ“š°ø
ÖĒ»ŪŠ”ø“Ļ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŹµŃ銔×é¶ŌŅ»ŗ¬ÓŠAl3£«µÄĪ“ÖŖČÜŅŗ½ųŠŠĮĖČēĻĀ·ÖĪö£ŗ£Ø1£©µĪ¼ÓÉŁĮæNaOHČÜŅŗ£¬ĪŽĆ÷ĻŌ±ä»Æ£»£Ø2£©¼ĢŠųµĪ¼ÓNaOHČÜŅŗ£¬ÓŠ°×É«½ŗד³ĮµķÉś³É£»£Ø3£©µĪ¼Ó¹żĮæµÄNaOHČÜŅŗ£¬°×É«½ŗד³ĮµķĆ÷ĻŌ¼õÉŁ”£ŹµŃ銔×龶ØĮæ·ÖĪö£¬µĆ³öČēĶ¼ĖłŹ¾³ĮµķµÄĪļÖŹµÄĮæÓėµĪ¼ÓNaOHČÜŅŗĢå»żµÄ¹ŲĻµ”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ(””””)

A. øĆĪ“ÖŖČÜŅŗÖŠÖĮÉŁŗ¬ÓŠ3ÖÖŃōĄė×Ó
B. NaOHČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ5 mol”¤L£1
C. ČōĮķŅ»ÖÖĄė×ÓĪŖ¶ž¼ŪŃōĄė×Ó£¬Ōņa£½10
D. Čō½«×īÖÕ³Įµķ¹żĀĖ”¢Ļ“µÓ”¢×ĘÉÕ£¬ĘäÖŹĮæŅ»¶ØĪŖ6 g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.µē½ā¾«Į¶ĶŹ±£¬Čō×ŖŅĘ2NAøöµē×Ó£¬ŌņŃō¼«¼õÉŁµÄÖŹĮæĪŖ64g
B.ŗĻ³É°±Éś²śÖŠ½«NH3Ņŗ»Æ·ÖĄė£¬æɼÓæģÕż·“Ó¦ĖŁĀŹ£¬ĢįøßH2µÄ×Ŗ»ÆĀŹ
C.![]() ŌŚ³£ĪĀĻĀÄÜ×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦µÄ”÷H£¾0
ŌŚ³£ĪĀĻĀÄÜ×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦µÄ”÷H£¾0
D.³£ĪĀĻĀ£¬![]() ”£ÓūŹ¹ČÜŅŗÖŠ
”£ÓūŹ¹ČÜŅŗÖŠ![]() £¬Ščµ÷½ŚČÜŅŗµÄ
£¬Ščµ÷½ŚČÜŅŗµÄ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
(1)ŌŚ±ź×¼×“æöĻĀ£¬ÓŠĪļÖŹ¢Ł44.8LH2£¬¢Ś24gCH4£¬¢Ū1molH2O£¬¢Ü3.01”Į1023øöN2£¬ŗ¬·Ö×ÓŹż×ī¶ąµÄŹĒ______£ØĢīŠņŗÅ£¬ĻĀĶ¬£©£¬ŗ¬µē×ÓŹż×ī¶ąµÄŹĒ________£¬ÖŹĮæ×ī“óµÄŹĒ______£¬Ģå»ż×īŠ”µÄŹĒ______£»ĆܶČÓÉŠ”µ½“óµÄĖ³ŠņĪŖ________________”£
(2)0.5molij¹ĢĢåAµÄÖŹĮæŹĒ40g£¬AµÄĦ¶ūÖŹĮæĪŖ_________”£
(3)ÖŹĮæÖ®±ČĪŖ8”Ć7µÄĮ½ÖÖĘųĢåO2”¢CO£¬Ęä·Ö×ÓŹżÖ®±ČĪŖ_______________£»ŃõŌ×ÓŹżÖ®±ČĪŖ____________£»ĻąĶ¬Ģõ¼žĻĀµÄĢå»żÖ®±ČĪŖ________”£
(4) 4.8gĢ¼ŌŚŅ»¶ØĮæµÄŃõĘųÖŠČ¼ÉÕ£¬·“Ó¦ŗóÉś³ÉCOŗĶCO2µÄ×ÜÖŹĮæĪŖ12.8g”£ŌņŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ£¬Éś³ÉµÄCOŗĶCO2µÄĢå»ż±ČĪŖ__________”£
(5)ÓÉNaHS£¬MgSO4£¬NaHSO3×é³ÉµÄ»ģŗĻĪļÖŠ£¬ĮņŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖa£„£¬Ōņ»ģŗĻĪļÖŠŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©Š“³öÖʱøĒāŃõ»ÆĢś½ŗĢåµÄ»Æѧ·½³ĢŹ½£ŗ___£»
£Ø2£©Š“³öŃĪĖį³żĢśŠā£ØÖ÷ŅŖ³É·ÖFe2O3£©µÄĄė×Ó·½³ĢŹ½£ŗ___£»
£Ø3£©Š“³öNaHSO4ČÜŅŗÓėBa(OH)2ČÜŅŗ»ģŗĻ³ŹÖŠŠŌµÄĄė×Ó·½³ĢŹ½£ŗ___£»
£Ø4£©Š“³öNaHCO3ČÜŅŗÓėÉŁĮæ³ĪĒåŹÆ»ŅĖ®·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ___£»
£Ø5£©Š“³öĮņĖįĶČÜŅŗÓėĒāŃõ»Æ±µČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĒæĖįŠŌČÜŅŗXÖŠŗ¬ÓŠBa2+”¢Al3+”¢NH4+”¢Fe2+”¢Fe3+”¢CO32-”¢SO32-”¢S![]() ”¢Cl-”¢N
”¢Cl-”¢N![]() ”£ÖŠµÄŅ»ÖÖ»ņ¼øÖÖ,Č”øĆČÜŅŗ½ųŠŠĮ¬ŠųŹµŃé,ŹµŃé¹ż³ĢČēĻĀ:(ŅŃÖŖĘųĢåDŌŚ³£ĪĀ³£Ń¹ĻĀ³Źŗģ×ŲÉ«)
”£ÖŠµÄŅ»ÖÖ»ņ¼øÖÖ,Č”øĆČÜŅŗ½ųŠŠĮ¬ŠųŹµŃé,ŹµŃé¹ż³ĢČēĻĀ:(ŅŃÖŖĘųĢåDŌŚ³£ĪĀ³£Ń¹ĻĀ³Źŗģ×ŲÉ«)

£Ø1£©ÉĻŹöĄė×ÓÖŠ,ČÜŅŗXÖŠ³żH+ĶāæĻ¶Ø»¹ŗ¬ÓŠµÄĄė×ÓŹĒ_,Ņ»¶Ø²»ŗ¬µÄĄė×ÓŹĒ__£¬²»ÄÜČ·¶ØŹĒ·ńŗ¬ÓŠµÄĄė×ÓŹĒ_______£¬¼ģŃéĘäÖŠŃōĄė×ӵķ½·ØŹĒ________”£
£Ø2£©³ĮµķGµÄ»ÆѧŹ½ĪŖ______”£
£Ø3£©Š“³öÉś³ÉAµÄĄė×Ó·½³ĢŹ½:________”£
£Ø4£©Š“³öČÜŅŗHÖŠĶØČė¹żĮæCO2µÄĄė×Ó·½³ĢŹ½:________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŹµŃ銔×éÓūĢ½¾æNa2CO3ŗĶNaHCO3µÄŠŌÖŹ£¬·¢ĻÖŹµŃéŹŅĄļŹ¢·ÅĮ½ÖÖ¹ĢĢåµÄŹŌ¼ĮĘæ¶ŖŹ§ĮĖ±źĒ©£®ÓŚŹĒ£¬ĖūĆĒĻȶŌ¹ĢĢåA”¢B½ųŠŠ¼ų±š£¬ŌŁĶعżŹµŃé½ųŠŠŠŌÖŹĢ½¾æ£®
£Ø1£©·Ö±š¼ÓČČ¹ĢĢåA”¢B£¬·¢ĻÖ¹ĢĢåAŹÜČČ²śÉśµÄĘųĢåÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£®AŹÜČČ·Ö½āµÄ»Æѧ·½³ĢŹ½ĪŖ_____£®
£Ø2£©³ĘČ”Į½ÖÖ¹ĢĢåø÷2g£¬·Ö±š¼ÓČėĮ½øöŠ”ÉÕ±ÖŠ£¬ŌŁø÷¼Ó10mL ÕōĮóĖ®£¬Õńµ“£¬»Öø“ÖĮŹŅĪĀ£¬·¢ĻÖNa2CO3¹ĢĢåĶźČ«Čܽā£¬¶ųNaHCO3¹ĢĢåÓŠŹ£Óą£¬ÓÉ“ĖµĆ³ö½įĀŪ_____£®
£Ø3£©ČēĶ¼ĖłŹ¾£¬ŌŚĘųĆÜŠŌĮ¼ŗƵÄ×°ÖĆ¢ńŗĶ¢ņÖŠ·Ö±š·ÅČėŅ©Ę·£¬½«ĘųĒņÄŚµÄ¹ĢĢåĶ¬Ź±µ¹ČėŹŌ¹ÜÖŠ£®
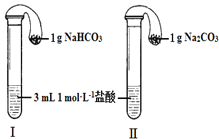
¢ŁĮ½ŹŌ¹ÜÖŠ¾ł²śÉśĘųĢ壬_____£ØĢī”°¢ń”±»ņ”°¢ņ”±£©µÄ·“Ó¦³Ģ¶ČøüĪŖ¾ēĮŅ£®
¢Ś·“Ó¦½įŹųŗó£¬ĘųĒņ¾łÓŠÅņÕĶ£¬»Öø“ÖĮŹŅĪĀ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_____£®
a ×°ÖĆ IµÄĘųĒņĢå»ż½Ļ“ó b ×°ÖĆ¢ņµÄĘųĒņĢå»ż½Ļ“ó
c ×°ÖĆ IµÄĘųĒņĢå»żµČӌװÖĆ¢ņµÄĘųĒņĢå»ż d ĪŽ·ØÅŠ¶Ļ
£Ø4£©Ķ¬Ń§ĆĒ½«Į½ÖÖ¹ĢĢå·Ö±šÅäÖĘ³É0.5molL©1µÄČÜŅŗ£¬Éč¼ĘČēĻĀ·½°ø²¢¶Ō·“Ó¦ĻÖĻó×ö³öŌ¤²ā£ŗ
ŹµŃé·½°ø | Ō¤²āĻÖĻó | Ō¤²āŅĄ¾Ż |
²Ł×÷1£ŗĻņ2mL Na2CO3ČÜŅŗÖŠµĪ¼Ó1mL 0.5molL©1CaCl2ČÜŅŗ | ÓŠ°×É«³Įµķ | Na2CO3ČÜŅŗÖŠµÄCO32©ÅØ¶Č½Ļ“ó£¬ÄÜÓėCaCl2·¢Éś·“Ó¦__________£ØŠ“Ąė×Ó·½³ĢŹ½£©£® |
²Ł×÷2£ŗĻņ2mL NaHCO3ČÜŅŗÖŠµĪ¼Ó1mL 0.5molL©1CaCl2ČÜŅŗ | ĪŽ°×É«³Įµķ | Na2CO3ČÜŅŗÖŠµÄCO32©ÅضČŗÜŠ”£¬²»ÄÜÓėCaCl2·¢Éś·“Ó¦”£ |
²Ł×÷1·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________£¬ŹµŹ©ŹŌŃéŗ󣬷¢ĻÖ²Ł×÷2µÄĻÖĻóÓėŌ¤²āÓŠ²īŅģ£¬²śÉś°×É«³ĮµķŗĶĘųĢ壬ŌņøĆĢõ¼žĻĀ£¬NaHCO3ČÜŅŗÓėCaCl2ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________.
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¢ń”¢Ä³Š£»ÆѧŠ”×éѧɜĄūÓĆČēĶ¼ĖłĮŠ×°ÖĆ½ųŠŠ”°ĢśÓėĖ®·“Ó¦”±µÄŹµŃ锣£ØĶ¼ÖŠ¼Š³Ö¼°Ī²Ęų“¦Ąķ×°ÖĆ¾łŅŃĀŌČ„£©
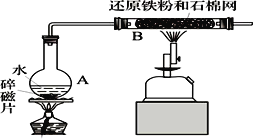
£Ø1£©ÉÕĘæµ×²æ·ÅÖĆĮĖ¼øʬĖé“Éʬ£¬Ėé“ÉʬµÄ×÷ÓĆŹĒ_____________________________”£×°ÖĆBÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ________________________________”£
£Ø2£©Ķ£Ö¹·“Ó¦£¬“żB¹ÜĄäČ“ŗó£¬Č”ĘäÖŠµÄ¹ĢĢ壬¼ÓČė¹żĮæĻ”ŃĪĖį³ä·Ö·“Ó¦£¬¹żĀĖ”£¼ņŹö¼ģŃéĀĖŅŗÖŠFe3+µÄ²Ł×÷·½·Ø____________________________________”£
¢ņ”¢ĄūÓƵē½āŹµŃéæÉŅŌÖĘµĆ“æ¾»µÄFe(OH)2°×É«³Įµķ£¬ČēĶ¼ĖłŹ¾£¬ŅŃÖŖĮ½µē¼«µÄ²ÄĮĻ·Ö±šĪŖŹÆÄ«ŗĶĢś”£
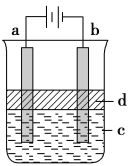
£Ø1£©aµē¼«µÄ²ÄĮĻÓ¦ĪŖ__________£¬µē¼«·“Ó¦Ź½ĪŖ__________________”£
£Ø2£©dĪŖ±½£¬Ęä×÷ÓĆŹĒ________________”£
£Ø3£©µ±µē½āŅ»¶ĪŹ±¼äŗó擵½°×É«Fe(OH)2³Įµķ£¬Č»ŗóĻņČÜŅŗÖŠĶØČėæÕĘų£¬æɹŪ²ģµÄĻÖĻóŹĒ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢WŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ”£Y”¢ZĶ¬ÖÜĘŚĒŅĻąĮŚ£¬X”¢WĶ¬Ö÷×åĒŅXÓėY“¦ÓŚ²»Ķ¬ÖÜĘŚ£¬Y”¢ZŌ×ӵĵē×ÓŹż×ÜŗĶÓėX”¢WŌ×ӵĵē×ÓŹż×ÜŗĶÖ®±ČĪŖ5”Ć4”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. Ō×Ó°ė¾¶£ŗr(W)£¾r(Z)£¾r(Y)£¾r(X)
B. YµÄ¼ņµ„ĘųĢ¬Ēā»ÆĪļµÄČČĪČ¶ØŠŌ±ČZµÄĒæ
C. ÓÉZ”¢W×é³ÉµÄ»ÆŗĻĪļÖ»ÓŠŅ»ÖÖ
D. ÓÉX”¢Y”¢ZČżÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļæÉŅŌŹĒĖį”¢¼ī»ņŃĪ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com