
【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
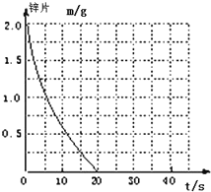
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
【答案】不同温度 不同浓度 298 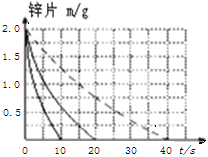 Zn和被Zn置换出的Cu、电解质溶液构成Zn--Cu原电池,加快反应速率
Zn和被Zn置换出的Cu、电解质溶液构成Zn--Cu原电池,加快反应速率
【解析】
(1)可根据实验设计推测实验目的,也可根据实验目的进行实验设计。分析数据可知:①②只有温度不同,①③只有浓度不同,由此可推知其实验目的;要将实验①④设计成用于探究相同温度和相同浓度的盐酸、醋酸与锌反应的反应速率,需要控制温度、浓度都相同。
(2)图中以单位时间内锌片减少的质量来表示反应速率,速率与时间成反比,结合题中所给醋酸与盐酸反应速率的关系,不难画出锌片质量与时间关系曲线。
(3)分析氯化铜加入反应体系中的变化,不难判断,使反应速率加快的原因是构成了原电池。
(1)a.实验①和②物质的温度不同,其它条件都相同,因此是探究不同温度对锌与盐酸反应速率的影响;b.实验①和③反应的温度相同,而盐酸的浓度不同,因此是探究不同浓度盐酸对锌与盐酸反应速率的影响;实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别,所以④反应温度与实验①相同,也是298K;故答案为:不同温度 不同浓度 298。
(2)实验②温度比实验①高10℃。由于反应温度每升高10℃,反应速率是原来的2倍,时间是原来的1/2,则Zn完全反应消耗的时间是10s,实验④中,温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2,则反应时间是①的2倍,为40s.故答案用图像表示为:

(3)Zn与CuCl2溶液发生反应:Zn+CuCl2=Cu+ ZnCl2,产生的Cu与Zn及电解质溶液形成原电池,加快了反应速率。故答案为:Zn和被Zn置换出的Cu、电解质溶液构成Zn--Cu原电池,加快反应速率。


科目:高中化学 来源: 题型:
【题目】燃煤脱硫的反应为2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H<0。500℃时,实验测得在2L刚性密闭容器中该反应在不同时刻O2、CO2的物质的量(或物质的量浓度)如下表所示,下列判断正确的是( )

A.0~10min内,平均反应速率v(SO2)=0.084mol·L-1·min-1
B.30min后,改变的条件只能是增大O2的通入量
C.若容器绝热,则20min时,![]() >
>![]()
D.化学平衡常数:30min<40min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的结构简式为_______。
(2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有_______种。(①与D具有相同的官能团,②苯环上的三元取代物)
(3)⑤的化学方程式为________。
(4)参照上述合成路线,若要合成最终产物为![]() 有机物,需要_________和_____________两种有机物通过一步反应制得。(在横线上写出有机物的结构简式)
有机物,需要_________和_____________两种有机物通过一步反应制得。(在横线上写出有机物的结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置进行电化学实验,相关说法正确的是![]()
![]()
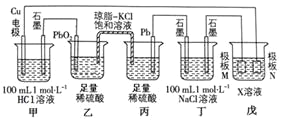
A.乙池中发生的电极反应式为:![]()
B.工作时,盐桥中的![]() 向丙池迁移,
向丙池迁移,![]() 向乙池迁移
向乙池迁移
C.当电路中通过![]() 电子时,甲、丁两池均产生
电子时,甲、丁两池均产生![]() 气体
气体
D.若戊池的目的是在铜材料上镀银,则极板N的材料应选择纯铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器内,使 1molN2和3molH2 混合发生下列反应:
3H2+N2![]() 2NH3 H<0
2NH3 H<0
(1) 升高温度时,混合气体的密度_____。(填:“变大”或“变小”或“不变”)
(2)当达到平衡时,充入 N2,平衡将_____移动。(填:“正向”或“逆向”或“不”, 下同)
(3)当达到平衡时,充入Ar气,平衡将_____移动。
(4)当达到平衡时,将 c(N2)、c(H2)、c(NH3)同时增大 1 倍,平衡将_____移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中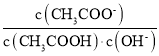 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:

(1)则25 ℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由________________。
(2)在25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是_______________________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL0.1mol·L-1的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH与CH3COOH溶液体积关系如下图所示,下列有关粒子浓度大小关系正确的是( )
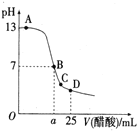
A.a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.水的电离程度:D>B>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com