
某密闭容器中进行如下反应:2X(g)+Y(g)⇌2Z(g),若要使平衡时反应物总物质的量与生成物的总物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足( )
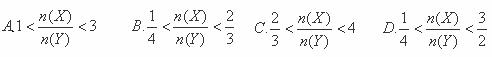
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO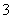 、SO
、SO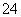 、Cl-、I-、HCO
、Cl-、I-、HCO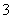 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是________;溶液中肯定不存在的离子是____________________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)_________________________ _______________________________________________。
(3)写出实验⑤中所有反应的离子方程式: ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:__________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO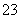 )∶n(HSO
)∶n(HSO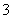 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 1∶91 |
| pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显________性,用化学平衡原理解释:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2 (g) 2SO3(g),下列判断中正确的是( )
2SO3(g),下列判断中正确的是( )
A.2体积SO2和足量O2反应,生成 2体积SO3
B.恒温恒容,通入气体氦使压强增大,平衡向右移动
C.平衡时,SO2消耗速率等于O2生成速率的两倍
D.平衡时,SO2浓度等于O2浓度的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对可逆反应aA(g)+bB(g)  cC(g)化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,
cC(g)化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,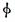 表示体积分数)。根据图象,下列判断正确的是( )
表示体积分数)。根据图象,下列判断正确的是( )
A.反应Ⅰ:若p1>p2,则此反应只能在高温下自发进行
B.反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:ΔH>0且T2>T1或ΔH<0且T2<T1
D.反应Ⅳ:T1<T2,则该反应不易自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
将NO2装入带活塞的密闭容器中,当反应2NO2(g) 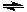 N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
|
温度/℃ | 1 | 2 | 4 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。下列说法正确的是 )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2g)+O2g)===2H2Ol) ΔH=-571.6 kJ·mol-1
B.已知:H2g)+F2g)===2HFg) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3g),放热19.3 kJ,其热化学方程式为N2g)+3H2g)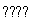 2NH3g) ΔH=-38.6 kJ·mol-1
2NH3g) ΔH=-38.6 kJ·mol-1
D.已知:①Cs,石墨)+O2g)===CO2g) ΔH=-393.5 kJ·mol-1 ②Cs,金刚石)+O2g)===CO2g) ΔH=-395.0 kJ·mol-1,则Cs,金刚石)===Cs,石墨) ΔH=-1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.信息产业中的光缆的主要成分是单质硅
B.利用激光笔可以区别鸡蛋清和浓盐水
C.油脂、糖类、蛋白质都属于天然高分子化合物
D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com