
| A. | 单质的熔点:钾<铷<铯 | B. | 离子半径:S2->Na+>Mg2+ | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:H2SiO3<H3PO4<H2SO4 |
分析 A.同一主族元素中,随着原子序数的递增,金属单质的熔点呈增大趋势;
B.离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小;
C.非金属性越强,对应氢化物的稳定性越强;
D.非金属性越强,最高价氧化物对应水合物的酸性越强.
解答 解:A.随着原子序数的递增,钾、铷、铯的熔点逐渐降低,即熔点钾>铷>铯,故A错误;
B.硫离子含有3个电子层,其离子半径增大,钠离子和镁离子含有2个电子层,镁离子的核电荷数较大,则离子半径Na+>Mg2+,所以离子半径离子半径大小为:S2->Na+>Mg2+,故B正确;
C.非金属性:F>O>S,非金属性越强,对应氢化物越稳定则热稳定性大小为:HF>H2O>H2S,故C正确;
D.非金属性:Si<P<S,非金属性越强,最高价氧化物对应水合物的酸性越强,则酸性强弱为:H2SiO3<H3PO4<H2SO4,故D正确;
故选A.
点评 本题考查了原子结构与元素周期律的关系及应用,题目难度不大,涉及熔沸点、离子半径、氢化物稳定性、最高价含氧酸酸性大小比较,明确元素周期律内容为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、CO32-、SO42- | B. | Mg2+、Cl-、Na+、SO42- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | K+、Na+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
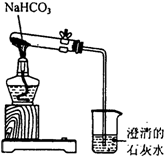 某实验小组的同学为探究碳酸钠、碳酸氢钠的性质,进行了如下实验.请按要求回答下列问题.
某实验小组的同学为探究碳酸钠、碳酸氢钠的性质,进行了如下实验.请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
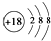 ④.过氧化氢的电子式:
④.过氧化氢的电子式:
 ⑥.乙醇的结构式:CH3CH2OH
⑥.乙醇的结构式:CH3CH2OH ⑧T原子可以表示为31H.
⑧T原子可以表示为31H.| A. | ①③⑤⑥⑦⑧ | B. | ①②③④⑦ | C. | ①⑦⑧ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
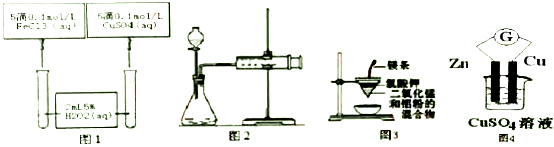
| A. | 若图Ⅰ所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| B. | 用图2装置可测定过氧化氢分解反应产生气体体积(液体体积忽略) | |
| C. | 用图3装置制备金属锰 | |
| D. | 用图4装置可验证化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com