
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
分析 A.熔沸点:原子晶体>离子晶体>分子晶体,金属晶体熔沸点差别较大;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.电子层结构相同的离子,离子半径随着原子序数增大而减小,电子层数越大离子半径越大;
D.分散质微粒直径:悬浊液>胶体>溶液.
解答 解:A.熔沸点:原子晶体>离子晶体>分子晶体,金属晶体熔沸点差别较大,金刚石是原子晶体、氯化钠是粒子晶体、冰是分子晶体、汞是金属晶体但常温下是液体,所以物质的熔点:石英>食盐>冰>汞,故A正确;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性N>Br>S>P,所以氢化物的稳定性为NH3>HBr>H2S>PH3,故B错误;
C.电子层结构相同的离子,离子半径随着原子序数增大而减小,电子层数越大离子半径越大,所以离子半径H->Li+>H+,故C正确;
D.分散质微粒直径:悬浊液>胶体>溶液,所以分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故D正确;
故选B.
点评 本题考查分散质粒子直径大小比较、氢化物稳定性判断、元素周期律、晶体熔沸点高低判断等知识点,综合性较强,明确晶体类型与晶体熔沸点关系、氢化物稳定性比较方法等知识点即可解答,注意氢化物的稳定性与化学键有关,熔沸点与分子间作用力及氢键有关,注意二者区别.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题
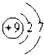 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
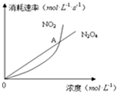 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
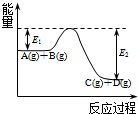 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
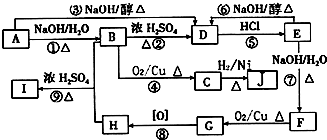
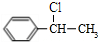 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基.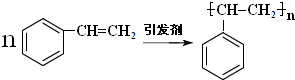 .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式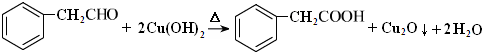 .
.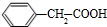 +
+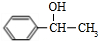 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$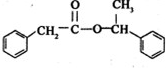 +H2O
+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com