
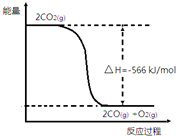
 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
分析 A、依据燃烧热的概念分析计算判断;
B、图象中的焓变是2molCO2完全分解反应的焓变;
C、根据盖斯定律利用题给热化学方程式合并消去二氧化碳得到热化学方程式;
D、放出热量的单位为KJ.
解答 解;A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B、图象中的焓变应是2molCO2完全分解反应的反应热,应为吸收566kJ,则生成物能量比反应物能量高,故B错误;
C、已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1,根据盖斯定律合并热化学方程式得到,$\frac{②×2+①}{2}$得到的热化学方程式为 CO(g)+Na2O2(s)=2Na2CO3(s);△H=-509kJ/mol,故C正确;
D、根据热化学方程式为Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1,则由②可知,反应生成Na2CO3固体106g,放出热量226kJ,故D错误;
故选C.
点评 本题考查了热化学方程式的书写判断,燃烧热的概念应用,反应焓变的意义,盖斯定律的应用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | |
| B. | FeCl3溶液用于铜质印刷线路板制作 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 84消毒液用于环境消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
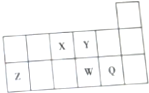
| A. | X的最高价氧化物对应水化物能与它的氢化物反应 | |
| B. | Y原子的电子总数是其K层电子数的3倍 | |
| C. | Z的氧化物能溶于氢氧化钠溶液 | |
| D. | Q的单质能与W的氢化物发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应涉及到了共价键和离子键的断裂和形成 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1molH-H键和1mol Cl-Cl键,所吸收的总能量,小于形成1molH-Cl键,所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C中官能团的名称是醛基;
,C中官能团的名称是醛基; ;
; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,金刚石比石墨稳定 | |
| B. | 金刚石与石墨之间的转化属于物理变化 | |
| C. | 破坏等质量的金刚石和石墨中的化学键,前者吸收的能量多 | |
| D. | 相同条件下,等质量的金刚石和石墨分别完全燃烧,前者放热多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com