
【题目】铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。

(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___周期__族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________。
(3)写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________。
(4)取75.8 g (CH3COO)2Pb nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。

①(CH3COO)2Pb nH2O中n=______。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________。
【答案】 六 IVA 增大接触面积,加快反应速率 用14 mol L-1的浓硝酸反应时,消耗的硝酸量更多且产生的有毒气体更多 (CH3COO)2Pb+2I-==PbI2↓+2CH3COO- 3 (CH3COO)2Pb![]() PbO+(CH3CO)2O[或(CH3COO)2Pb
PbO+(CH3CO)2O[或(CH3COO)2Pb![]() PbO+C4H6O3] 4×10-9
PbO+C4H6O3] 4×10-9
【解析】(1)碳是第二周期元素ⅣA,铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第六周期元素ⅣA;
(2)接触面积越大,反应速率越快,将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率;铅具有还原性,硝酸具有强氧化性,铅和稀硝酸反应生成硝酸铅、一氧化氮和水,化学方程式为:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,铅与浓硝酸发生氧化还原反应,生成硝酸铅,二氧化氮和水,反应的化学方程式为Pb+4HNO3(浓)=Pb(NO3)2+2NO2↑+2H2O,与稀硝酸相比,含等物质的量HNO3时,浓硝酸溶解的铅较少,且放出的污染气体较多,;
⑶(CH3COO)2Pb溶液能氧化I-生成,且(CH3COO)2Pb为弱电解质不可拆分,此反应的离子方程式为 (CH3COO)2Pb+2I-==PbI2↓+2CH3COO- ;
(4)①75.8 g (CH3COO)2Pb nH2O样品加热至75℃时剩余固体为65克,样品在75℃时已完全失去结晶水,生成的水质量为75.8g-65g=10.8g,则醋酸铅与水的物质的量之比![]() ︰
︰![]() =1:3,则n=3;
=1:3,则n=3;
②铅的氧化物质量为44.6克,醋酸铅的物质的量为![]() =0.2mol,根据铅原子守恒,铅的氧化物(PbOx)的物质的量为0.2mol,此氧化物的摩尔质量为
=0.2mol,根据铅原子守恒,铅的氧化物(PbOx)的物质的量为0.2mol,此氧化物的摩尔质量为![]() =223g/mol,为PbO,有机物的质量为65g-44.6g=20.4g,此有机物分子内应含有四个碳原子,物质的量为0.2mol,摩尔质量为20.4g÷0.2mol=102g/mol,根据原子守恒可知有机物的分子式为C4H6O3,结构简式为(CH3CO)2O,则该温度区间内分解反应的化学方程式为(CH3COO)2Pb
=223g/mol,为PbO,有机物的质量为65g-44.6g=20.4g,此有机物分子内应含有四个碳原子,物质的量为0.2mol,摩尔质量为20.4g÷0.2mol=102g/mol,根据原子守恒可知有机物的分子式为C4H6O3,结构简式为(CH3CO)2O,则该温度区间内分解反应的化学方程式为(CH3COO)2Pb![]() PbO+(CH3CO)2O;
PbO+(CH3CO)2O;
(5)n(H+)=n(NaOH)=0.002500molL-1×20.00mL×10-3LmL-1=5.000×10-5mol
n[Pb2+(aq)]=![]() n(H+)=2.500×10-5mol;c(Pb2+)=
n(H+)=2.500×10-5mol;c(Pb2+)=![]() =1.000×10-3molL-1,Ksp(PbI2)=c(Pb2+)c2(I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9。
=1.000×10-3molL-1,Ksp(PbI2)=c(Pb2+)c2(I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9。


科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为由具支试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
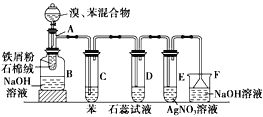
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应,写出A中所发生反应的化学方程式(有机物写结构简式):_____________________,
(2)试管C中苯的作用是___________________________。反应开始后,观察D和E两试管,看到的现象为D中_________________,E中________________。
(3)反应2~3min后,在B中的NaOH溶液里可观察到的现象是___________________。
(4)在上述整套装置中,具有防倒吸作用的装置有______________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如图所示,该电池反应为Mg+ClO-+H2O=Mg(OH)2+Cl-下列有关说法正确的是

A. 电池工作时,c溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO--2e-+H2O=Cl-+2OH-
D. b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,错误的是( )
A. 二氧化硫常用于漂白纸浆 B. 漂粉精可用于游泳池水消毒
C. 碳酸钡可用来治疗胃酸过多 D. 氧化铁常用于红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使1.0体积的某气态烷烃和烯烃的混合气体在足量空气中完全燃烧,生成2.0体积的二氧化碳和2.2体积的水蒸气(均在120℃、1.01×105Pa条件下测定),则混合气体中烷烃和烯烃的体积比为
A. 2:3 B. 1:4 C. 4:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体置于2L的密闭容器中,混合后发生如下反应:2A(g)+ B(g) = 2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确是
A. 用物质A表示的反应速率为1. 2 mol / (L s)
B. 用物质B表示的反应速率为0. 3 mol / (L s)
C. 2 s时物质A的转化率为30%
D. 2 s时物质B的浓度为0.6 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:X(g)+2Y(g) ![]() Z(g)反应过程中测定的部分数据见下表:
Z(g)反应过程中测定的部分数据见下表:
反应时间/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
下列说法正确的是
A. 前10 min内反应的平均速率为v(Z)=0.10 mol·L-1·min-1
B. 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应
C. 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L
D. 保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则下列说法正确的是( )

A. 混合烃中一定不含有乙烯 B. 混合烃中n(C)∶n(H)=2∶5
C. 若混合烃为CH4、C3H4,则体积比为3∶7 D. 若混合烃为CH4、C4H4,则体积比为4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com