
【题目】下列说法正确的是
A. BF3和NH3的空间构型都为平面三角形
B. 晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI
C. 熔点:Na-K合金<氯化钠<钠<金刚石
D. 空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积
【答案】B
【解析】A、B形成3个δ键,孤对电子数为![]() =0,为sp2杂化,BF3立体构型为平面三角形,而N形成3个δ键,孤对电子数为
=0,为sp2杂化,BF3立体构型为平面三角形,而N形成3个δ键,孤对电子数为![]() =1,为sp3杂化,NH3立体构型为三角锥形,选项A错误;B.离子晶体晶格能与离子电荷成正比,与离子半径成反比,从F到I其简单阴离子半径随着原子序数增大而增大,所以其晶格能随着原子序数增大而减小,则晶格能由大到小:NaF>NaCl>NaBr>NaI,选项B正确;C、合金熔点比各成份都低,不同类型的晶体熔点的高低顺序为:原子晶体>离子晶体>金属晶体>分子晶体,所以熔点Na-K合金<钠<氯化钠<<金刚石,选项C错误;D、体心立方堆积的空间利用率为68%,六方最密堆积=面心立方最密堆积空间利用率74%,所以空间利用率为:体心立方堆积<六方最密堆积=面心立方最密堆积,选项D错误;答案选B。
=1,为sp3杂化,NH3立体构型为三角锥形,选项A错误;B.离子晶体晶格能与离子电荷成正比,与离子半径成反比,从F到I其简单阴离子半径随着原子序数增大而增大,所以其晶格能随着原子序数增大而减小,则晶格能由大到小:NaF>NaCl>NaBr>NaI,选项B正确;C、合金熔点比各成份都低,不同类型的晶体熔点的高低顺序为:原子晶体>离子晶体>金属晶体>分子晶体,所以熔点Na-K合金<钠<氯化钠<<金刚石,选项C错误;D、体心立方堆积的空间利用率为68%,六方最密堆积=面心立方最密堆积空间利用率74%,所以空间利用率为:体心立方堆积<六方最密堆积=面心立方最密堆积,选项D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应过程中一定有电子转移
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程失去电子
D.失去电子的反应是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子(或在指定条件下)能大量共存的是( )
A. 中性溶液:Na+、Fe3+、Cl-、NO3-
B. NH4+、Na+、NO3-、SiO32-
C. 麦芽糖溶液中:SO42-、MnO4-、K+、H+可以大量共存
D. 0.1mol /LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
A. 若XY2是共价化合物,则X与Y的原子序数可能相差1
B. 若XY2是离子化合物,则X与Y的原子序数可能相差8
C. 若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小
D. 若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n)
B. SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构
C. M层电子数为奇数的主族元素所在族的序数与该元素原子的M层电子数不一定相等
D. 由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为____。
(2)上述反应中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900℃ D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1, 则可知 C 的热值为 110.5 kJ·mol1
C. 0℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)![]() H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
H2(g)+I2(g)。下列叙述中,一定属于平衡状态的是
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不再变化
C. 混合气体的总压强不再变化
D. v(HI)∶v(H2)∶v(I2)=2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究某矿石(仅含四种短周期元素)的组成和性质,已知矿石含有一定的结晶水:
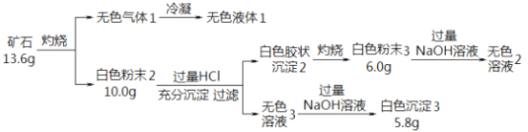
(1)矿石的组成元素是 H、O 和_____、 ______(填元素符号),化学式为_____________。
(2)白色粉末3 溶于NaOH溶液的离子方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com