



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
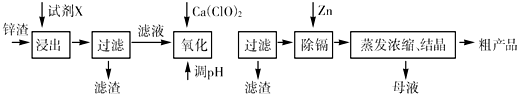
(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为 (填名称)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。(从以下选项选择, 填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是 (填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是 。
查看答案和解析>>
科目:高中化学 来源:2012届广东省潮汕两市名校高三上学期期中联考理综试题(化学部分) 题型:填空题
(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: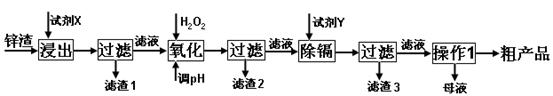
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为 (填名称)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。(从以下选项选择, 填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是 (填化学式,下同)。
(4)“试剂Y”是______________;“滤渣3”的成分为______________________。
(5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省连州市高三10月月考理科综合化学试卷(解析版) 题型:实验题
(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
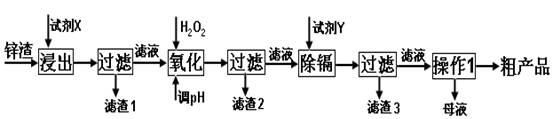
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选 。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com