
| 选项 | 规律 | 结论 |
| A | 较强酸可以制备较弱酸 | 硫化氢通入硫酸铜溶液中不反应 |
| B | 压强越大,反应速率越快 | 加压,该反应2NH3?N2+3H2的正反应速率加快 |
| C | 金属性较强的金属为原电池的负极 | 铁、铜和浓硝酸形成的原电池,铁为负极 |
| D | 主族元素的最高正化合价等于主族的序数 | 氧的最高正化合价是+6 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫化氢通入硫酸铜溶液中会生成硫化铜沉淀;
B.对于有气体参加的反应,压强越大,反应速率越快;
C.原电池中,失电子的电极是负极,活泼金属不一定是负极,还考虑电解质溶液;
D.氧无最高正价.
解答 解:A.硫化氢通入硫酸铜溶液中会生成硫化铜沉淀,故A错误;
B.对于有气体参加的反应,压强越大,反应速率越快,加压,该反应2NH3?N2+3H2的正反应速率加快,故B正确;
C.原电池中,失电子的电极是负极,活泼金属不一定是负极,还考虑电解质溶液,浓硝酸与铁发生钝化反应,在表面生成一层致密的氧化物膜而阻碍反应继续进行,负极为铜,故C错误;
D.氧无最高正价,结论不正确,故D错误.
故选B.
点评 本题考查了物质的性质方面的知识,难度适中,解题时要注意一般规律与特殊情况的关系,以及规律所适用的条件等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 压强不再随时间而改变时 | |
| B. | 混合气体中各组成成分的含量不再改变时 | |
| C. | 气体的总质量不再改变时 | |
| D. | 单位时间内消耗1 mol I2,同时有2 mol HI生成时 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
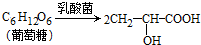
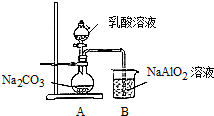
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
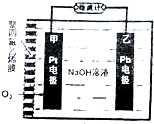 氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )
氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )| A. | Pt电极上发生氧化反应 | |
| B. | Pt上发生的电极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 反应过程中转移OH-的物质的量为0.25bmol | |
| D. | 待测气体中氧气的体积分数为0.7$\frac{b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能发生取代反应 | B. | C4H10(丁烷)有三种同分异构体 | ||
| C. | 氨基酸、淀粉均属于高分子化合物 | D. | 油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
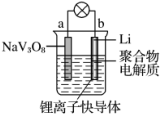 水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )
水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 该电池可以用硫酸钠溶液作电解质 | |
| C. | 充电过程中阳极的电极反应式:NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 充电过程中Li+从阳极向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打不仅可用于治疗胃病,还可作灭火剂 | |
| B. | 用酸洗灼烧后的铂丝蘸取样品灼烧,火焰呈紫色,说明该样品中含钾元素 | |
| C. | 纯铁的熔点比生铁的低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com