
分析 (1)如HA是HCN,反应后为等浓度的HCN、NaCN的混合溶液,根据溶液呈电中性的角度比较离子浓度大小;
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度;
(2)氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,一水合氨是弱电解质,相同浓度的溶液中一水合氨中铵根离子浓度最小;
(3)Na2CO3为强碱弱酸盐,水解显碱性;
(4)①水电离出的c(OH-)=0.01mol•L-1,溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,pH=-lg c(H+);
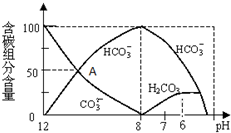
②酸性条件下,能存在大量碳酸,碱性条件下,能存在大量碳酸根离子;
③根据图判断C元素存在形式.
解答 解:(1)如HA是HCN,反应后为等浓度的HCN、NaCN的混合溶液,根据溶液电中性原则可知c(Na+)+c(H+)=c(CN-)+c(OH-),由于c(Na+)>c(CN-),则c(H+)<c(OH-);
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,则c(CH3COOH)<c(CH3COO-),
故答案为:<;<;
(2)氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,一水合氨是弱电解质,相同浓度的溶液中一水合氨中铵根离子浓度最小,浓度相等的这几种溶液中铵根离子浓度大小顺序是②>①>④>③,故答案为:②>①>④>③;
(3)土壤中Na2CO3含量较高时,pH可以高达10.5,因为Na2CO3为强碱弱酸盐,水解显碱性,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-;
故答案为:CO32-+H2O?HCO3-+OH-;
(4)①水电离出的c(OH-)=0.01mol•L-1,溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,pH=-lg c(H+)=12,故答案为:12;
②H2CO3是二元弱酸,分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,HCO3-分别与H2CO3、CO32-都能共存,酸性条件下,能存在大量碳酸,碱性条件下,存在大量碳酸根离子,因为二者存在环境不同,所以H2CO3和CO32-在溶液中不能大量共存,
故答案为:不能;
③根据图知,人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故答案为:HCO3-.
点评 本题考查弱电解质的电离和盐类水解,侧重考查学生分析判断及识图能力,明确弱电解质电离及盐类水解原理是解本题关键,难点是(2)题离子浓度大小比较,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com