
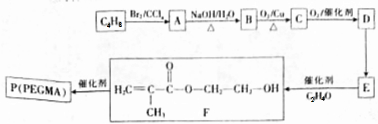
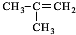 .
.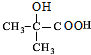 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$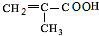 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.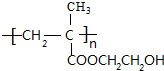 .
.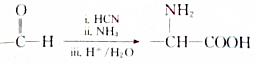 .设计由B合成
.设计由B合成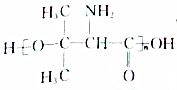 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.
分析 F发生加聚反应生成高分子化合物P为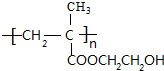 .C4H8系列转化得到F,转化中C4H8的碳骨架不变,可知C4H8为
.C4H8系列转化得到F,转化中C4H8的碳骨架不变,可知C4H8为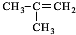 ,与溴发生加成反应生成A为
,与溴发生加成反应生成A为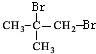 ,A发生水解反应生成B为
,A发生水解反应生成B为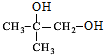 ,B氧化是生成C为
,B氧化是生成C为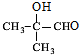 ,C进一步氧化生成D为,
,C进一步氧化生成D为,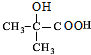 ,D发生消去反应生成E为
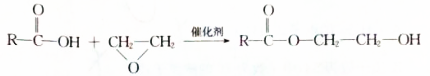
,D发生消去反应生成E为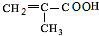 ,E与环氧乙烷发生类似加成反应生成F.
,E与环氧乙烷发生类似加成反应生成F.
(7)由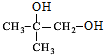 氧化得到
氧化得到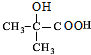 ,
,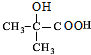 发生信息中反应得到
发生信息中反应得到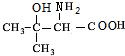 ,再发生缩聚反应得到
,再发生缩聚反应得到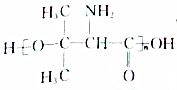 .
.
解答 解:F发生加聚反应生成高分子化合物P为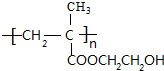 .C4H8系列转化得到F,转化中C4H8的碳骨架不变,可知C4H8为
.C4H8系列转化得到F,转化中C4H8的碳骨架不变,可知C4H8为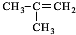 ,与溴发生加成反应生成A为
,与溴发生加成反应生成A为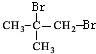 ,A发生水解反应生成B为
,A发生水解反应生成B为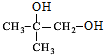 ,B氧化是生成C为
,B氧化是生成C为 ,C进一步氧化生成D为,
,C进一步氧化生成D为,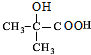 ,D发生消去反应生成E为
,D发生消去反应生成E为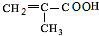 ,E与环氧乙烷发生类似加成反应生成F.
,E与环氧乙烷发生类似加成反应生成F.
(1)B为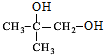 ,官能团的名称是:羟基,故答案为:羟基;
,官能团的名称是:羟基,故答案为:羟基;
(2)原料C4H8的结构简式是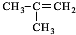 ,故答案为:
,故答案为: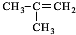 ;
;
(3)反应D→E是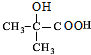 发生消去反应生成
发生消去反应生成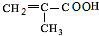 ,反应方程式为:
,反应方程式为: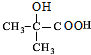 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$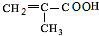 +H2O,
+H2O,
故答案为: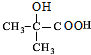 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$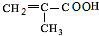 +H2O,消去反应;.
+H2O,消去反应;.
(4)P的结构简式是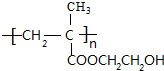 ,故答案为:
,故答案为: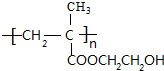 ;
;
(5)D(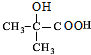 )的一种同分异构体,发生分子内酯化反应生成五元环状化合物,则该同分异构体的结构简式是:HOCH2CH2CH2COOH,
)的一种同分异构体,发生分子内酯化反应生成五元环状化合物,则该同分异构体的结构简式是:HOCH2CH2CH2COOH,
故答案为:HOCH2CH2CH2COOH;
(6)满足下列条件的F的同分异构体:①能使石蕊试剂变红,说明含有羧基,②能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,说明含有醛基,③结构中只有一个-CH3,为OHCCH2CH2CH2COOH被-CH3取代,有3种,为OHCCH2CH2COOH被-CH2CH3取代,有2种,为OHCCH2COOH被-CH2CH2CH3取代,有1种,故共有6种,
故答案为:6;
(7)由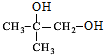 氧化得到
氧化得到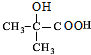 ,
,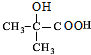 发生信息中反应得到
发生信息中反应得到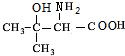 ,再发生缩聚反应得到
,再发生缩聚反应得到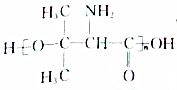 ,合成路线流程图为:
,合成路线流程图为: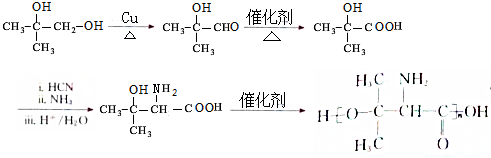 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,根据F的结构、结合反应条件采取正逆推法相结合进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力、知识迁移运用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 分子式是C20H12O4 | B. | 能与NaOH稀溶液反应,溶液显红色 | ||
| C. | 能与溴水反应,溶液显红色 | D. | 与羧酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时pH=6的纯水中含有10-6NA个H+ | |
| B. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 在25℃、1.01×105Pa时,121gCF2Cl2所含的氯原子数为2NA | |
| D. | 常温下,5.6g铁投入到足量的浓硝酸中,反应转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
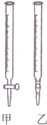 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当pH=7时,若V1=V2,则一定是c2>c1 | |
| B. | 在任何情况下都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 若pH>7,则一定是c1V1>c2V2 | |
| D. | 若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com