
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
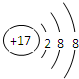 ,故答案为:Na;F;
,故答案为:Na;F; ;
;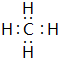 ;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程为:
;⑤与⑨形成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程为: ,
,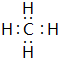 ;
; ;
;

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、64g氧气中含氧分子数为2NA |
| B、1.7g OH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g水中含有的氢原子数为2NA |
| B、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| C、2mol硝酸镁固体中含有的硝酸根离子数为4NA |
| D、1mol氧中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两池的电极材料如图所示,请按要求回答下列问题:
甲、乙两池的电极材料如图所示,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子鉴定方案(实验操作步骤) | 预期的现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家用Pb-磷化物催化二氧化碳和丁二烯发生化学反应,得到的主要产物甲的键线式如图所示,请回答下列问题:
科学家用Pb-磷化物催化二氧化碳和丁二烯发生化学反应,得到的主要产物甲的键线式如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、③④ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com