


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、a>b | B、a=b |
| C、a<b | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热的纯碱溶液洗涤粘有油脂的餐具 |
| B、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
| C、用米汤检验食用加碘盐(含KIO3)中含有碘 |
| D、用灼烧方法鉴别羊毛布料和纯棉布料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
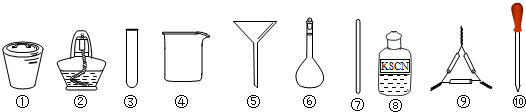
| A、将茶叶灼烧灰化,选用①、②和⑨ |
| B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C、过滤得到的滤液,选用④、⑤和⑦ |
| D、检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的阴离子的电子排布式是1s22s22p63s23p6 |
| B、X的最高价氧化物对应的水化物的酸性比砷酸强 |
| C、X的最高价氧化物中,X的质量分数为50% |
| D、X的气态氢化物的水溶液呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com