
���� 2minĩ��Ӧ�ﵽƽ��״̬����ʱC��A����C��B����C��C��=1��2��4����ת����BΪnmol����
3A��g��+B��g��?x C��g��+D��l��
��ʼ 3 2 0
ת�� 3n n xn
ƽ�� 3-3n 2-n xn
$\frac{3-3n}{2-n}=\frac{1}{2}$�����n=0.8mol��
$\frac{1}{0.6}=\frac{4}{0.8x}$�����x=3��
���c=$\frac{n}{V}$��ת����=$\frac{ת������}{��ʼ����}$��100%��v=$\frac{��c}{��t}$�����ʵ����ȵ���ѹǿ�ȼ��㣮
��� �⣺2minĩ��Ӧ�ﵽƽ��״̬����ʱC��A����C��B����C��C��=1��2��4����ת����BΪnmol����
3A��g��+B��g��?x C��g��+D��l��
��ʼ 3 2 0
ת�� 3n n xn
ƽ�� 3-3n 2-n xn
$\frac{3-3n}{2-n}=\frac{1}{2}$�����n=0.8mol��
$\frac{1}{0.6}=\frac{4}{0.8x}$�����x=3��
��1��������������֪��xֵ����3���ʴ�Ϊ��3��
��2��Bƽ��ʱ��Ũ��Ϊ$\frac{��2-0.8��mol}{2L}$=0.6mol/L���ʴ�Ϊ��0.6��
��3��A��ת����Ϊ$\frac{3��0.8mol}{3mol}$��100%=80%���ʴ�Ϊ��80%��
��4����C��ʾ�ķ�Ӧ����Ϊ$\frac{\frac{3��0.8mol}{2L}}{2��60s}$=0.01 mol/��L•s�����ʴ�Ϊ��0.01��
��5��ƽ����뿪ʼʱ����ѹǿ�����������Ϊ$\frac{3-3��0.8+2-0.8+3��0.8}{3+2}$=21��25���ʴ�Ϊ��21��25��
��6��������䣬DΪҺ�壬��Ӧ�������ʱ��������������С�����ڴﵽƽ��Ĺ����У�������ܶ�һֱ��С���ʴ�Ϊ����С��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η���ת���ʼ����ʼ����Ϊ���Ĺؼ������ط�������������Ŀ��飬ע��DΪҺ�壬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ü�ʽ�ζ�����ȡ16.00 mL KMnO4��Һ | |
| B�� | ���Ҵ���ȡˮ��Һ�е��嵥�� | |
| C�� | ��������ƽ��ȡ5.6 gʳ�� | |
| D�� | �ñ�����ζ�δ֪Ũ�ȵ�NaOH��Һ������������Ϊ21.5 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H6O��C2H4 | B�� | C6H12O2��C5H12O | C�� | C2H6O��C3H6O2 | D�� | CH4��C2H4O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 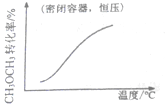 CH3OCH3��g��+3H2O��g��?6H2��g��+2CO2��g������H��0 | B�� | 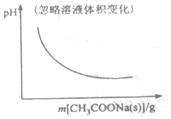 CH3COOH?H++CH3COO- | ||
| C�� | 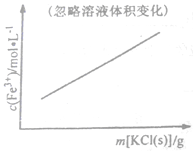 FeCl3+3KSCN?Fe��SCN��3+3KCl | D�� | 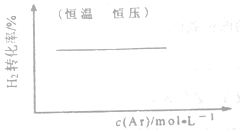 N2��g��+3H2��g��?2NH3��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0��15 s����I2��ʾ��ƽ����Ӧ����Ϊv��I2��=0.001 mol•L-1•s-1 | |
| B�� | c��HI����0.07 mol•L-1����0.05 mol•L-1����ķ�Ӧʱ��С��10 s | |
| C�� | �����¶�����Ӧ���ʼӿ죬�淴Ӧ���ʼ��� | |
| D�� | ��С��Ӧ��ϵ���������ѧ��Ӧ���ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���CH3OH������������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ•mol-1
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���CH3OH������������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ•mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1 | B�� | 3��2 | C�� | 2��3 | D�� | 3��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com