
下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
[化学——选修3: 物质结构与性质](15分)
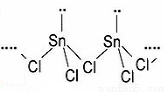
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。
(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。

(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
(4)锡的某种氧化物的晶胞如右图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度 为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:简答题
(10分)请按要求写出下列化学方程式
①乙烯使硫酸酸化的高锰酸钾溶液褪色(乙烯被氧化为二氧化碳,高锰酸钾被还原为硫酸锰MnSO4)。
②甲苯在浓硫酸作催化剂的条件下与浓硝酸反应生成三硝基甲苯。
③乙醇使硫酸酸化的重铬酸钾溶液变色(乙醇被氧化为乙酸,重铬酸钾被还原为硫酸铬)。
④乙烯与氧气在银作催化剂的条件下反应生成环氧乙烷,且该反应的原子利用率为?
⑤对苯甲二甲酸与乙二醇缩聚反应生成聚酯纤维(涤纶)。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )
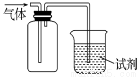
选项 | 试剂 | 现象 | 结 论 |
A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
C | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 |
D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性,没有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。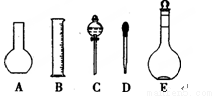
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为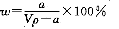
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中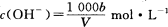
D.溶质的物质的量浓度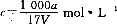
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
B | c(OH-)=1×10-13mol/L溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应Fe2++NO3-+4H+=3Fe3++NO+2H2O |
C | 溶液中: K+、Cu2+、Cl-、NH3?H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
在常温常压下,下列四种气态烃各1mol分别在足量氧气中燃烧,消耗氧气最多的是
A. CH4 B. C2H6 C. C3H8 D. C4H10
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是 ( )
A.H35Cl、H37Cl属于同素异形体
B.16O与18O的中子数不同,核外电子排布却相同
C.稳定性:CH4>SiH4;还原性:HCl>H2S
D.K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com