
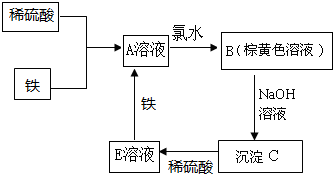
 下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:
下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:分析 根据题中各物质的转化关系,铁与稀硫酸反应生成A为硫酸亚铁溶液,硫酸亚铁溶液与氯气反应生成B为含有铁离子的溶液,B与氢氧化钠反应生成沉淀C为Fe(OH)3,C与稀硫酸反应生成E为Fe2(SO4)3溶液,Fe2(SO4)3与铁反应生成硫酸亚铁,符合各物质的转化关系,据此答题.
解答 解:根据题中各物质的转化关系,铁与稀硫酸反应生成A为硫酸亚铁溶液,硫酸亚铁溶液与氯气反应生成B为含有铁离子的溶液,B与氢氧化钠反应生成沉淀C为Fe(OH)3,C与稀硫酸反应生成E为Fe2(SO4)3溶液,Fe2(SO4)3与铁反应生成硫酸亚铁,符合各物质的转化关系,
(1)根据上面的分析可知,E溶液中溶质的化学式为 Fe2(SO4)3,若将Fe(OH)3加热至恒重,Fe(OH)3受热分解最终得到的物质是 Fe2O3,
故答案为:Fe2(SO4)3; Fe2O3;
(2)A为硫酸亚铁溶液,A溶液中滴加入NaOH溶液,生成氢氧化亚铁沉淀,振荡,放置一段时间,氢氧化亚铁被空气中氧气氧化成氢氧化铁,所以可以观察到的现象是产生白色沉淀,逐渐变成灰绿色,最终变成红褐色,发生反应的化学方程式有FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:产生白色沉淀,逐渐变成灰绿色,最终变成红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,亚铁离子被氧气氧化成铁离子,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O.
点评 本题考查了无机物转化关系和物质性质的理解应用,主要是变价金属发生的反应分析判断,溶液颜色变化特征是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 、
、 .
. .
. 、
、 .
. 、
、
 +
+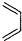 $\stackrel{△}{→}$
$\stackrel{△}{→}$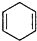 ,如果要合成
,如果要合成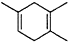 所用的原始原料可以是AC
所用的原始原料可以是AC查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水,再加入KSCN溶液,溶液显红色,则溶液中一定含有Fe2+ | |
| B. | 加入盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| C. | 加入Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则溶液中一定含有SO42- | |
| D. | 加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ③④⑤ | C. | ①②⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中NaClO是氧化剂 | |
| C. | Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2molFeCl3发生反应,转移电子的物质的量为6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com