
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
【答案】B
【解析】
第一份溶液中白色沉淀为BaSO4,质量为1.7475g,则n(BaSO4)=0.0075mol,即n(SO![]() )=0.0075mol;另一份溶液中,通过反应式:n(Fe2+):n(Cr2O72-)=6:1,n(Cr2O72-)=0.0200mol/L╳0.05L=0.001mol,求得n(Fe2+)=0.006mol,亚铁离子即由原溶液中的铁离子转化得到,根据物质不显电荷,即可求出答案。
)=0.0075mol;另一份溶液中,通过反应式:n(Fe2+):n(Cr2O72-)=6:1,n(Cr2O72-)=0.0200mol/L╳0.05L=0.001mol,求得n(Fe2+)=0.006mol,亚铁离子即由原溶液中的铁离子转化得到,根据物质不显电荷,即可求出答案。
1.7475 g白色沉淀是硫酸钡,则n(SO![]() )=1.7475 g÷233 g/mol=0.0075 mol。n(K2Cr2O7)=0.05 L×0.02000 mol/L=0.001 mol,根据方程式可知n(Fe2+)=n(K2Cr2O7)×6=0.006 mol,根据Fe守恒,n(Fe3+)=0.006mol,由电荷守恒可知n(OH-)+n(SO
)=1.7475 g÷233 g/mol=0.0075 mol。n(K2Cr2O7)=0.05 L×0.02000 mol/L=0.001 mol,根据方程式可知n(Fe2+)=n(K2Cr2O7)×6=0.006 mol,根据Fe守恒,n(Fe3+)=0.006mol,由电荷守恒可知n(OH-)+n(SO![]() )×2=n(Fe3+)×3,n(OH-)=0.006 mol×3-0.0075 mol×2=0.003 mol,得到a∶b=0.006∶0.003=2∶1,故答案为B。
)×2=n(Fe3+)×3,n(OH-)=0.006 mol×3-0.0075 mol×2=0.003 mol,得到a∶b=0.006∶0.003=2∶1,故答案为B。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】对矿井下空气进行氧气含量测定既能保证矿工的身体健康又能为瓦斯灾害处理提供数据。缺氧场所常采用伽伐尼电池型氧传感器检测氧气浓度,该传感器结构如图所示,工作电极为Pb,对比电极为Pt,电池液为KOH溶液。下列说法不正确的是

A.氧在对比电极被还原
B.工作电极的电极反应为Pb+2OH--2e-=Pb(OH)2
C.外电路电子由对比电极流向工作电极
D.该传感器测定氧气浓度时不需外加电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从制溴苯的实验中分离出FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是

A.用装置甲制取氯气按图示通入装置乙中能使Br-全部转化为溴单质
B.用装置丙分液时先从下口放出水层,换一容器从上口倒出有机层
C.检验溶液中是否氧化完全,取水层少许滴加硝酸银溶液,看有无沉淀生成
D.用装置丁将分液后的水层溶液蒸发至有大量晶体析出时,停止加热,余热蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:
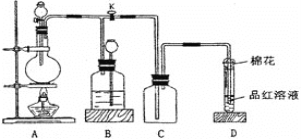
(1)装置A中发生的化学反应方程式为____________;此反应表明浓硫酸具有_________(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
(2)装置D中试管口放置的棉花中浸入__________溶液,其作用是_____________。
(3)装置B的作用是贮存多余的气体,B中应放置的液体是__________(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法不正确的是

A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中涉及到非极性键的断裂和极性键的形成
C.反应II为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D.总反应为:2H2O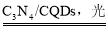 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时将a g NH3完全溶于水得到V mL溶液,该溶液的密度为ρg·cm-3,质量分数为w。下列说法正确的是
A. 溶质的质量分数w=a/(Vρ-a)×100%
B. 溶质的物质的量浓度c= a/17V mol·L-1
C. 溶液密度ρ可表示为 17c/w g·cm-3
D. 上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )

A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼单质在高温时是良好的导体,也是用途广泛的化工原料。镁单质可用于制造轻金属合金、球墨铸铁等。硼镁矿的主要成分为Mg2B2O5·H2O,可以制取单质硼和镁。制取工艺流程如图所示,已知硼砂的化学式为Na2B4O7·10H2O,硼镁泥是硼镁矿制硼砂过程中产生的废渣,其主要成分是MgCO3,还含有CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。按要求回答问题:
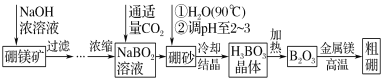
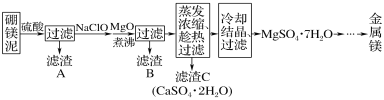
(1)化合物Mg2B2O5·H2O中B的化合价为_____。
(2)将硼砂溶于热水后,常用稀硫酸调pH至2~3制取H3BO3,该反应的离子方程式为____。
(3)写出加NaClO的过程中发生反应的离子方程式:________;________。
(4)将硼镁泥中加入的硫酸改为盐酸是否可行?___。(填“是”或“否”),理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
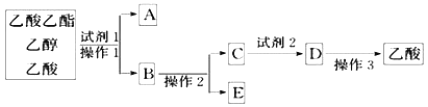
(1)试剂1最好选用_______;
(2)操作1是_______;
(3)试剂2最好选用_______;
(4)操作2是_______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com