
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是

A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
【答案】C
【解析】
A、B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A正确;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,因此装置C的作用是吸收SO2尾气,防止污染空气,故B正确;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故C错误;
D、铁离子氧化二氧化硫为硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入氯化钡生成白色沉淀说明反应进行生成了硫酸根离子,故D正确;
故答案选C。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜片放入0.1mol·L-1FeCl3溶液中,反应一段时间后取出铜片,溶液中![]() ,则反应后溶液中
,则反应后溶液中![]() 与
与![]() 的物质的量之比为 ( )
的物质的量之比为 ( )
A. 3:2 B. 3:4 C. 3:5 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气主要含有丙烯、1,3-丁二烯等不饱和烃,以它们为原料可合成CR橡胶和医药中间体G,,合成路线如下:

已知:①B、C、D 均能发生银镜反应;
②
(1)A的顺式异构体的结构简式为___________________。
(2)C中含氧官能团的名称是____________,反应①的反应类型为____________________。
(3)写出E→ 反应的化学方程式:_________________________________。
(4)写出同时满足下列条件的医药中间体G的同分异构体的结构简式: __________________。
①与D 互为同系物; ②核磁共振氢谱有三组峰。
(5)用简要语言表述检验B中所含官能团的实验方法:_______________________。
(6)以A为起始原料合成CR橡胶的线路为______________________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:
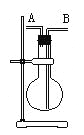
① H2②Cl2③CH4④HCl ⑤NH3⑥NO ⑦NO2⑧SO2,
下列操作正确的是
A. 烧瓶是干燥的,由A进气收集①③⑤
B. 烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C. 在烧瓶中充满水,由A进气收集①③⑤⑦
D. 在烧瓶中充满水,由B进气收集⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
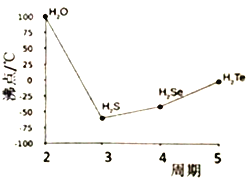
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程;

已知NaN3能与AgNO3反应生成白色难溶于水的AgN3;有关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | ||
CH3OH | —9 | 64.7 | 与水互溶 | |
水合肼(N2H4H2O) | 2 | 113.5 | 与水、醇互溶, 不溶于乙醚和氯仿 | |
亚硝酸甲酯(CH3ONO) | —17 | —12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为___________;步骤Ⅱ中生成NaN3的化学方程式为_______。
(2)实验室模拟步骤Ⅱ实验装置如下图(装置中冷却水省略,下同):
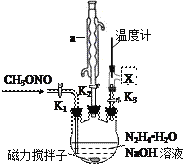
①仪器a的名称__________________,作用是________________________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是______________________________。
③图中X处连接的最合适装置应为下图中的_________。
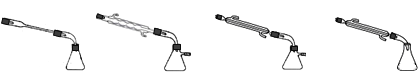
A B C D
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A进行蒸馏的合理操作顺序是__________。
①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用______________洗涤晶体。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现,即溶液呈淡红色为终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是_____________。下列操作合理的是______。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数会导致测定结果偏高
E.若发现滴液过量,可回滴样品溶液,至红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
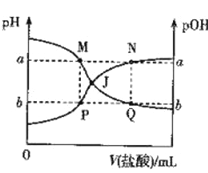
A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某兴趣小组根据教材中实验设计的一个能够说明碳酸钠与碳酸氢钠热稳定性的套管实验,请观察图示实验装置结合相关实验原理,判断下列有关的说法和做法其中不科学的是( )
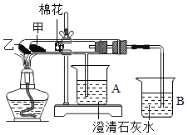
A. 甲为小苏打,乙为纯碱
B. 若要证明干燥碳酸氢钠受热分解能产生水,可以在小试管内塞上蘸有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com