
������ȷ�������У�������
��CO2��NO2��P2O5������������
��Ca��HCO3��2��Fe��OH��3��FeCl2�����ɻ��Ϸ�Ӧ�Ƶ�
�۵⾧���ɢ���ƾ��С������Ȼ�����Һ�����ˮ�����γɵķ�ɢϵ�ֱ�Ϊ����Һ������
�����ȵ�̿��CO2�ķ�Ӧ��Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ����Ϊ������ԭ��Ӧ���������ȷ�Ӧ
����Ҫͨ��ſɽ��е��У����롢��⡢��ơ��绯ѧ��ʴ
���Ȼ�����Һ����������������еĹ�ͬ�����ǣ�������ֽ���������ɡ����պ�������������
�߿��Լء������ᡢ������˳���������Ϊ��ǿ����ʡ�������ʺͷǵ����
�����Ԫ�غͷǽ���Ԫ���γɵĻ�����һ�������ӻ����
| �� | A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
| �������ǵ���ʣ��������Ҫ���ʣ�. | |
| ������ | ���ܺͼӦ�����κ�ˮ��������Ϊ��������� ��Ca��HCO3��2��Fe��OH��3��FeCl2�����ɻ��Ϸ�Ӧ�Ƶ� �۵⾧���ɢ���ƾ����γɵķ�ɢϵ����Һ���Ȼ��ƾ����ɢ���ƾ������γɵķ�ɢϵ�ǽ��壻 ��������ԭ��Ӧ����ǰ�������Ԫ�ػ��ϼ۵ı仯������ �ݵ�������Һ��ˮ���ӻ����������½��У��绯��ʴ���γ�ԭ��ط�Ӧ�����ĸ�ʴ�� ����Һ�ͽ�����ͨ����ֽ����Һ�����������õ�ˮ�����ֽ������������� ��ǿ�������ָ��ˮ����ȫ��������ӵĻ�������������ָ��ˮ�в���ȫ���룬ֻ�в��ֵ���Ļ������ˮ��Һ�������״̬�¶�������Ļ������Ƿǵ���ʣ� �����Ԫ�غͷǽ���Ԫ���γɵĻ�����Ҳ�����ǹ��ۻ���� |
| ��� | �⣺��NO2�ͼӦ���������ơ��������ƣ�������������ԭ��Ӧ��������������������������Ķ��壬�ʢٴ��� ��CaCO3+CO2+H2O=Ca��HCO3��2��4Fe��OH��2+O2+2H2O=4Fe��OH��3��2FeCl3+Fe=3FeCl2�����ɻ��Ϸ�Ӧ�Ƶã��ʢ���ȷ�� �۵⾧���ɢ���ƾ��С������Ȼ�����Һ�����ˮ�����γɵķ�ɢϵ�ֱ�Ϊ����Һ�����壬�ʢ���ȷ�� ��Ba��OH��2•8H2O��NH4Cl�ķ�ӦԪ�ػ��ϼ۲��䣬������������ԭ��Ӧ���ʢܴ��� �ݵ�⡢��Ӿ�������ͨ�磬��������Һ��ˮ���ӻ����������½��У��绯��ʴ���γ�ԭ��ط�Ӧ�����ĸ�ʴ������Ҫͨ�磬�ʢݴ��� ����Һ�ͽ�����ͨ����ֽ�������Ȼ�����Һʱ��������ˮ�������������������ɡ�����ʱ���������ֽ�������������ˮ�����������������ʱ�۳����ɳ��������ɡ�����ʱ���������ֽ�������������ˮ���ʢ���ȷ�� ���������Ƿǵ���ʣ��ǵ�����ǻ�����ʢߴ��� �����Ԫ�غͷǽ���Ԫ���γɵĻ����ﲻһ�������ӻ����Ҳ�����γɹ��ۻ������AlCl3�ǹ��ۻ�����ʢ���� �����������ڢۢ���ȷ�� ��ѡ��A�� |
| ������ | ������һ���ۺ��⣬�漰�����������Һ�����塢����ʡ��ǵ���ʡ����ӻ�������롢��⡢��Ӿ����ơ��绯��ʴ�ȸ���������Ӧ�ã�������ȷ���ջ����ǹؼ��� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й��ڷ�ɢϵ��˵������ȷ����(����)
A��ϡ����Ƿ�ɢϵ
B��һ�ַ�ɢϵ��ֻ�з�ɢ�ʺͷ�ɢ����������
C����ɢ��һ����Һ��
D����ɫ�������ڽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵ�ת���ڸ�����������ʵ�ֵ��ǣ�������
��CaCO3 CaO
CaO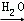 Ca��OH��2
Ca��OH��2
��AlCl3��aq�� NaAlO2��aq��
NaAlO2��aq��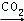 Al��OH��3
Al��OH��3
��FeS2 SO3
SO3 H2SO4
H2SO4
��NH3 NO2
NO2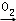 NO2
NO2 HNO3
HNO3
��NaCl��aq�� Na
Na Na2O2��
Na2O2��
| �� | A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ɫ�Ļ��������п��ܺ���NO��CO2��NO2��NH3��N2�еļ��֣���100mL�������ͼʵ�鴦��������õ�������Һ��������������ʣ�࣬���������ɿ���Ϊ��������
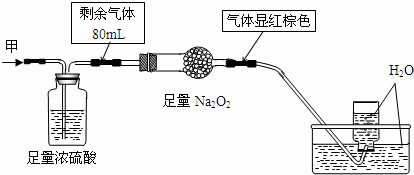
| �� | A�� | NH3��NO2��N2 | B�� | NH3��NO��CO2 | C�� | NH3��NO2��CO2 | D�� | NO��CO2��N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ�����Ӧԭ�Ӱ뾶�����ݣ���ش��������⣺
| Ԫ������ | Ԫ�ر�� | |||||||
| A | B | C | D | E | F | G | H | |
| ԭ�Ӱ뾶��nm�� | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| ����ϼ� | +6 | +4 | +5 | +5 | +4 | +7 | ||
| ��ͻ��ϼ� | ��2 | ��4 | ��2 | ��3 | ��1 | ��3 | ��4 | ��1 |
��1��Ԫ��G�������е�λ����������Ԫ��F���γɵij������ʵĵ���ʽΪ������
��2��A��B��C��E�ļ��⻯���ȶ���˳�����������û�ѧʽ�ش𣩣�
��3���������ΪACH2��������ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᣮ�÷�Ӧ�Ļ�ѧ����ʽ��������
��4����д��B�ĵ��ʵ�һ����Ҫ��;����������ҵ����ȡ�õ��ʵ�ԭ����ӦΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ͼ��������Ϊ����������������Ϊ��������������Ӧѡ���ȷ���ǣ�������
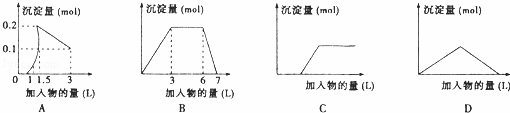
| �� | A�� | ��1LŨ�Ⱦ�Ϊ0.1mol/L��Ba��OH��2��NaAlO2���Һ�м���0.1 mol/LϡH2SO4��Һ |
| �� | B�� | ����0.1 mol/L AlCl3��0.3mol/L NH4Cl��1L���Һ�м���0.1mol/L NaOH��Һ |
| �� | C�� | ���ռ���Һ�еμ�������Һ |
| �� | D�� | ��Ca��OH��2��Һ����ͨ�������̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڿ��淴ӦN2��g��+3H2��g��⇌2NH3��g��+Q��Q��0�������о�Ŀ�ĺ�ʾ��ͼ������� ��������
| A | B | C | D | |
| �о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ͼʾ |
|
|
|
|
| �� | A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ���������۱�����ȷ���ǣ�������
| �� | A�� | ֽ����ʵ������ѡ��ˮ���̶��࣬�л��ܼ��������࣬����ˮ��ǿ�ijɷ����������з������һЩ����ëϸ���������£����������ƶ����ٶȿ�һЩ |
| �� | B�� | �ж�CuO��MnO2��H2O2�ֽ�Ĵ�Ч�ʣ���ͨ���Ƚ�H2O2��Һ�������ݵĿ����̶ȣ���ⶨ��λʱ���ڲ������������ |
| �� | C�� | ʳ�����Ậ���ⶨʵ���У�ʵ�����ʱ��ʽ�ζ��ܼ��첿λ�����ݣ���ⶨ�Ĵ��Ậ��ƫ�� |
| �� | D�� | ����������������淋Ļ����Һ����Ũ������ȴ�ᾧ�������Ħ���δֲ�Ʒ�����þƾ�ϴȥ��������ˮ�֣����Ⱥ�ɺ���أ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ijһ��Һ�п��ܺ������м������ӣ�K+��Fe3+��Ag+��Ba2+��NO2—��AlO2—��CO32����SO32—��SO42—��ij����Һ�����й�ʵ�飬ʵ�鲽�輰������£�
������Һ�м������ϡ���ᣬ�õ��������Һ�ף�
������Һ���м������NH4HCO3 ��Һ���õ���ɫ�����ҡ������Һ���Һ�ң�
������Һ���м������Ba(OH)2 ��Һ�����ȣ��õ���ɫ�����������������Һ����
�ܼ�������ס������ҡ����������ֻ����һ�ֳɷ֣����Ҹ�����ͬ��
����˵����ȷ���� ( )
A���������ΪCO2 ����SO2
B����������һ������BaCO3�����ܺ���BaSO4
C������Һ�п϶����ڵ�������K+��AlO2—��SO32—��SO42—��NO2—
D��ֻ����ʵ����ܵó���Һ��һ��û��Fe3+��Ag+��Ba2+��K+�Ƿ������ȷ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com