
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |


科目:高中化学 来源: 题型:
| A、原子半径呈周期性变化 |
| B、元素化合价呈周期性变化 |
| C、电子层数逐渐增加 |
| D、元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
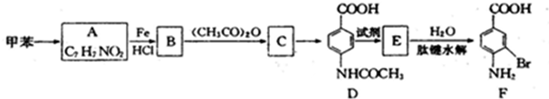
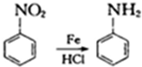
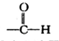 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生析氢腐蚀 |
| B、铁粉作阴极发生氧化反应 |
| C、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| D、可以吸热,从而降低温度,起保鲜糕点的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | H-O | H-H | C-O | C=O |
| 键能/KJ mol-1 | 413 | 463 | 436 | 358 | 802 |
 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度/mol?L-1 | 2.00 | 0.50 | 0 |
| 平衡浓度/mol?L-1 | c1 | 1.00 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
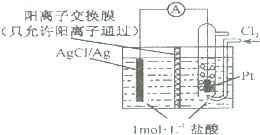
| A、正极反应为Cl2-2e-=2Cl- |
| B、放电时H+从右侧经阳离子交换膜移向左侧 |
| C、电路中转移0.01 mole-时,交换膜左侧溶液中减少0.01 mol离子 |
| D、若用NaCl溶液代替盐酸,电池的总反应不会改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
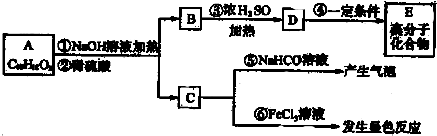
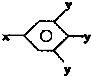 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
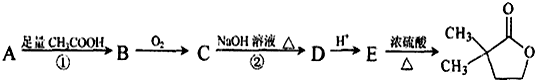
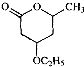 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从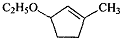 到
到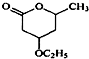 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件).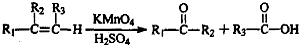 ;
;| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
 .
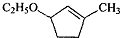
.
| H2O |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com