
| A. | 酸性 | B. | 氧化性 | C. | 还原性 | D. | 漂白性 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将4 molCl2通入到含4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+ | |
| B. | 已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大.将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O=2 Al(OH)3↓+SO32- | |
| C. | 稀氨水吸收了少量的二氧化碳气体:2NH3•H2O+CO2=2NH4++H2O+CO32- | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 常温常压下,18 g H2O中含有2nA个氢原子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
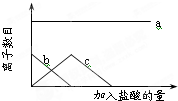 向一定量的Na2CO3溶液中缓慢滴入稀盐酸,并不断搅拌,随着盐酸的加入,溶液中自由离子的数目也随之发生如图所示变化.坐标系中a、b、c三条曲线分别对应的离子是( )
向一定量的Na2CO3溶液中缓慢滴入稀盐酸,并不断搅拌,随着盐酸的加入,溶液中自由离子的数目也随之发生如图所示变化.坐标系中a、b、c三条曲线分别对应的离子是( )| A. | Na+ CO32- H+ | B. | Cl-Na+ CO32- | ||
| C. | Na+HCO3- CO32- | D. | Na+ CO32- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 葡萄糖中花青素在碱性环境下显紫色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3中:c(Na+)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | Na2CO3溶液:c(OH-)═c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中:c(H+)+c(M+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 浓硫酸在常温下不能与铜片反应放出二氧化硫气体 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H20(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com